Следует признать, что ввиду целого ряда объективных причин до настоящего времени антибактериальная терапия у подавляющего большинства пациентов с внебольничной пневмонией (ВП) носит эмпирический характер. В этих условиях важное практическое значение приобретает тактика ведения больных, «не отвечающих» на проводимое лечение.
Актуальность рассматриваемой проблемы обусловливает тот факт, что неэффективность антибиотикотерапии наблюдается у значительного числа больных переносящих ВП. Известно, что более 17% пациентов с нетяжелой ВП, получающих лечение в амбулаторных условиях, и 6-15% госпитализированных больных «не отвечают» должным образом на проводимую антибактериальную терапию [1, 2]. А среди больных с тяжелым течением пневмонии, исходно поступающих в отделения реанимации и интенсивной терапии (ОРИТ), ухудшение состояния на фоне потенциально эффективной терапии в отдельных исследованиях достигает 40% [3].
Очевидно, что неэффективность лечения напрямую сопряжена с риском неблагоприятного исхода пневмонии. Так, летальность среди больных, «не ответивших» на лечение, значительно выше, чем у пациентов с адекватным ответом на антибиотикотерапию. По некоторым данным у госпитализированных больных с ВП, «не ответивших» на лечение, неатрибутивная летальность достигает 49% [4, 5], а в случае ранней неэффективности терапии сообщается о частоте летальных исходов, составляющей 27% [6].
Другой проблемой, наблюдаемой при неэффективности антибактериальной терапии ВП, является увеличение сроков госпитализации пациента, привлечение целого ряда диагностических исследований, необходимость модификации антимикробной терапии и пр., что ведет к значительному росту прямых затрат на лечение [7].
Согласно современным представлениям под термином «пневмония, не отвечающая на лечение» понимают ситуации, при которых, несмотря на проводимую антибактериальную терапию, не наблюдается адекватный клинический ответ [8].
Общепринятыми сроками оценки эффективности антибактериальной терапии ВП являются первые 48–72 ч. На основании этого критического для больных ВП временного интервала (72 часа от начала лечения) определяют раннюю или позднюю неэффективность антибактериальной терапии.
Помимо этого у госпитализированных пациентов выделяют две разновидности неэффективности лечения [3, 8]. К первой из них относят так называемую прогрессирующую пневмонию или истинное клиническое ухудшение, сопровождающееся развитием, как правило, в первые 72 ч от момента поступления больного в стационар острой дыхательной недостаточностью, требующей вентиляционной поддержки, и/или септического шока. Ухудшение состояния пациента чаще всего связано с неэффективной терапией, развитием осложнений ВП, наличием внелегочных очагов инфекции или с альтернативным пневмонии заболеванием. Известно, в частности, что около 50% больных ВП, находящихся в отделении интенсивной терапии (ОИТ), первоначально поступали в отделение общего профиля (терапевтическое, пульмонологическое), откуда в последующем ввиду прогрессирующего течения заболевания переводились в ОИТ [5]. Позднее прогрессирующее ухудшение состояния больных ВП (спустя 72 часа от начала лечения) чаще всего обусловливается присоединением нозокомиальной суперинфекции либо обострением/декомпенсацией сопутствующих заболеваний внутренних органов [3]. В этом контексте особый интерес представляют данные, свидетельствующие о генетической предрасположенности к генерализованному воспалительному ответу при пневмонии и даже летальному исходу заболевания. Так, известно, что степень тяжести ВП ассоциируется с генетическими изменениями локуса IL-10 (1082) [9, 10]. Другое генетическое отклонение, связываемое с модификацией белка теплового шока 70-2, характеризуется возрастанием риска развития септического шока при пневмонии [11].
Ко второй разновидности неэффективности лечения больных ВП в стационаре относят «персистирующую» пневмонию или пневмонию «не отвечающую» должным образом на антибиотикотерапию. В данном случае имеет место замедленное обратное развитие клинических симптомов заболевания, наблюдаемое в 15-25% случаев [11, 12].
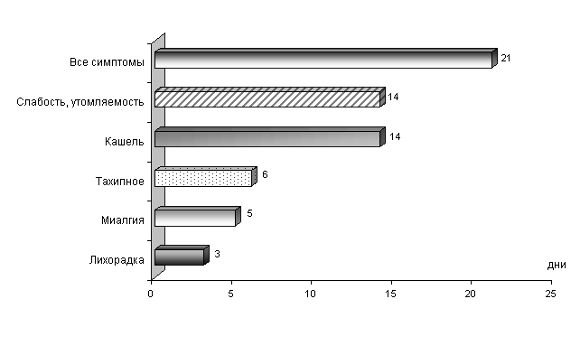
Ожидаемые сроки разрешения клинических симптомов пневмонии у больных, демонстрирующих адекватный «ответ» на антибактериальную терапию, представлены на рисунке 1. Лихорадка на фоне адекватного лечения регрессирует на 2-4 сутки лечения. К числу других критических точек, определяющих эффективность терапии, относят частоту сердечных сокращений и дыхательных движений, показатели систолического артериального давления, сатурация гемоглобина кислородом и пр. (так называемые критерии клинической стабильности ). У больных, ответивших на лечение, среднее время достижения соответствующих значений вышеуказанных критериев составляет 3 суток, напротив, пациентам с персистирующей пневмонией требуется 6 дней и более.
Рисунок 1. Среднее время разрешения клинических симптомов у больных с ВП
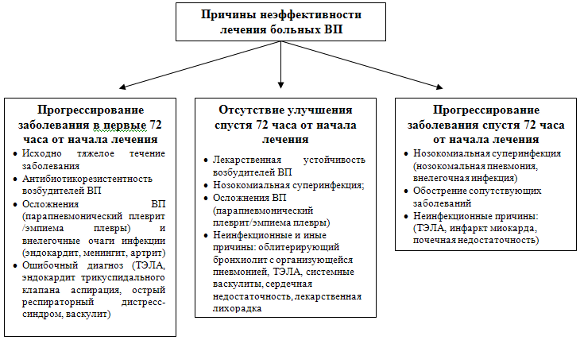
Причинами неэффективности лечения ВП могут быть обострение/декомпенсация сопутствующих заболеваний, присоединение нозокомиальной суперинфекции, а также многочисленные неинфекционные заболеваний, нередко ошибочно принимаемые за пневмонию, а именно, тромбоэмболия ветвей легочной артерии (ТЭЛА), системные васкулиты, сердечная недостаточность, лекарственные пневмопатии, легочные эозинофилии и др. (рис. 2) [14].
Рисунок 2. Причины неэффективности лечения больных с ВП
В значительной части случаев (>40%) неээфективность терапии, как при «прогрессирующей», так и «персистирующей» пневмонии обусловливается инфекционными причинами: это может иметь место как первичная инфекция, вызванная, в частности, лекарственноустойчивыми штаммами возбудителей, так нозокомиальная суперинфекция [3]. При этом в ряду наиболее частых микробиологических находок фигурируют Streptococcus pneumoniae, Legionella pneumophila, Staphylococcus aureus и Pseudomonas aeruginosa [18-19].
К сожалению, в реальной клинической практике конкретную причину неэффективности антибактериальной терапии ВП не удается установить едва ли не в половине случаев [1].
Выделение представленных вариантов неэффективности лечения ВП имеет важное практическое значение, так как определяет дальнейшую тактику ведения пациента. Очевидно, что модификация антибактериальной терапии оправдана только при прогрессирующей пневмонии, в случаях получения данных микробиологических исследований, указывающих на выделение культуры микроорганизмы с природной или приобретенной устойчивостью к назначавшимся антимикробным препаратам или вновь открывшихся эпидемиологических данных, позволяющих предполагать альтернативную этиологию заболевания.
В определенных клинических ситуациях, когда на фоне улучшения клинической картины к исходу 4-й недели (30 дней) от начала заболевания не удается достичь полного рентгенологического выздоровления, следует говорить о неразрешающейся (медленно разрешающейся) или затяжной ВП [8, 18, 19]. Данный вариант течения заболевания рассматривается отдельно от пневмонии, «не отвечающей» на лечение, и требуют иных подходов к ведению больного.
Если анализу причин неэффективности лечения ВП было посвящено значительное число исследований, то к предикторам (факторам риска) неэффективности внимание врачей едва ли не впервые было привлечено в 2004 году благодаря результатам исследований А. Menеndez и соавт. [1] и B. Roson и соавт. [6]. В первом из них к числу самостоятельных прогностических факторов неэффективности эмпирической антибиотикотерапии были отнесены: проживание в доме престарелых, сопутствующие заболевания печени и желудочно-кишечного тракта; достоверно ассоциировалось с увеличением риска неэффективности лечения ВП наличие у пациента лейкопении и гипонатриемии; мультилобарное распространение пневмонической инфильтрации, такие осложнения ВП как абсцедирование, плевральный выпот увеличивали риск терапевтической неудачи в 2-4 раза; неэффективность антибиотикотерапии чаще отмечалась у пациентов с тяжелым течением заболевания - в 13,5% и 35% случаев у пациентов пациентов IV и V классов риска по шкале PORT соответственно).
При этом несколько неожиданным представлялся тот факт, что у пациентов с сопутствующей ХОБЛ частота случаев неэффективность лечения оказалась ниже, что могло быть связано с терапией глюкокортикоидами, обладающими непревзойденным противовоспалительным действием [20]. Впрочем, подтверждение данного предположения требует дополнительных исследований.
В цитируемом исследовании (А. Menеndez и соавт. [1]) не было выявлено взаимосвязи между видом возбудителя ВП и эффективностью антибактериальной терапии. Однако были выявлены существенные различия в эффективности лечения в зависимости от применения того или иного антимикробного препарата (или их комбинации). Примечательно при этом, что в 84% случаев больные получали терапию, соответствовавшую современным рекомендациям по лечению ВП у взрослых (табл.1).
Таблица 1. Анализ неэффективности различных режимов терапии ВП [1]
| Антибиотик | Неэффективность терапии, % | Ранняя неэффективность, % |
| Цефалоспорины III поколения | 16 | 12 |
| Цефалоспорины III поколения + макролиды | 14,8 | 9,8 |
| «Ингибиторозащищенные» аминопенициллины | 14 | 7,2 |
| Фторхинолоны* | 10,4 | 5,6 |
| Другие схемы | 20,2 | 13,9 |
* 89,5% пациентов получали левофлоксацин, 5,7% моксифлоксацин, 4,8% ципрофлоксацин
Авторами было показано, что применение «респираторных» фторхинолонов (прежде всего, левофлоксацина) обусловливает лучший исход заболевания, по-видимому, за счет высокой активности антибиотиков в отношении всех потенциальных возбудителей ВП, включая лекарственноустойчивые штаммы S.pneumoniae [21].
Было показано также, что помимо выбора оптимальной антибактериальной терапии снижение вероятности терапевтической неудачи корреспондировала с предшествующим введением поливалентной пневмококковой вакцины.
В исследовании B.Roson и соавт.[6] была выявлена отчетливая связь между ранней неэффективностью терапии и этиологической структурой заболевания. Отмечено, в частности, что пневмония, вызываемая L.pneumophila и грамотрицательными энтеробактериями, ассоциируется с высокой вероятностью ранней неэффективности антибиотикотерапии. Другим важным фактором риска терапевтической неудачи является назначение антимикробных препаратов, не соответствующих клиническим рекомендациям [6].
С практической точки зрения важно выделить модифицируемые факторы риска, т.е., на которые врач способен повлиять: а) выбор антибактериальной терапии, конкордантной современным рекомендациям; б) предсказание (с учетом анализа соответствующих клинико-эпидемиологических данных) или установление (на основании результатов экспресс-диагностики) этиологии пневмонии (например, пневмония, вызванная грамотрицательными микроорганизмами, легионеллезная пневмония и пр.) (табл. 2).
Таблица 2. Факторы риска неэффективности лечения больных ВП
| Факторы риска неэффективности | Неэффективность лечения в целом [1] | Ранняя неэффективность лечения [6] | ||
| Снижение риска | Повышение риска | Снижение риска | Повышение риска | |
| Возраст > 65 лет | - | - | 0,35 | - |
| ХОБЛ | 0,60 | - | - | - |
| Заболевания печени | - | 2,0 | - | - |
| Вакцинация | 0,30 | - | - | - |
| Плевральный выпот | - | 2,7 | - | - |
| Мультилобарная инфильтарация | - | 2,1 | - | 1,81 |
| Абсцедирование | - | 4,1 | - | - |
| Лейкопения | - | 3,7 | - | - |
| IV и V классы риска по шкале PORT | - | 1,3 | - | 2,75 |
| Легионеллезная пневмония | - | - | - | 2,71 |
| Пневмония, вызванная грамотрицательными микроорганизмами | - | - | - | 4,34 |
| Терапия «респираторными» фторхинолонами | 0,5 | - | - | - |
| Антибактериальная терапия, соответствующая рекомендациям | - | - | 0,61 | - |
| Антибактериальная терапия, не соответствующая рекомендациям | - | - | - | 2,51 |
Как уже говорилось выше, дискордантная современным рекомендациям антибактериальная терапия является независимым фактором риска ранней неэффективности [6, 23]. Это положение остается весьма актуальным для реальной практики ведения больных ВП в РФ [24, 25]. Так, в ходе недавно проведенного многоцентрового фармакоэпидемиологического исследования была проанализирована практика применения системных антимикробных препаратов у взрослых пациентов с ВП в многопрофильных лечебно-профилактических учреждениях (ЛПУ) различных регионов нашей страны и оценено её соответствие национальным рекомендациям. Ретроспективно была изучена первичная медицинская документация (истории болезни и листы врачебных назначений) 3798 больных ВП (средний возраст 49,5±19,9 лет, 58% мужчин, 29,5% — с тяжёлым течением заболевания), госпитализированных в 29 ЛПУ 13 городов РФ в 2005-2006 гг. Наиболее часто в качестве стартовой монотерапии нетяжёлой ВП применялись цефотаксим (28,3%), ампициллин (21,2%) и цефтриаксон (17,3%), при тяжёлой ВП — ампициллин (26%), цефотаксим (18,3%) и цефтриаксон (14,8%); комбинации АМП назначались в 15,7 и 33,7% случаев при нетяжёлом и тяжёлом течении заболевания соответственно. Выбор стартового режима АБТ соответствовал национальным рекомендациям при нетяжёлой ВП в 72,3%, а при тяжёлой - всего лишь в 14,7% случаев [26].
Другой важной проблемой, характерной для амбулаторной практики лечения ВП и обусловливающей значительное число случаев неэффективности терапии, является низкая комплаентность (т.е. приверженность врачебным рекомендациям) пациентов. Справедливость этого заключения многократно подтверждалась результатами клинических исследований, демонстрировавших значительное снижение эффективности антибиотикотерапии ВП при несоблюдении пациентами предписанного режима лечения [27-29]. Более широкое применение антибиотиков с оптимальными фармакологическими характеристиками (кратность приема 1-2 раза в сутки, приемлемый профиль безопасности и пр.) в реальной клинической практике позволит снизить количество случаев неэффективности терапии.
Важнейшим моментом ведения пациентов с ВП является оценка тяжести состояния больного, возможно требующего госпитализации и принципиально иных подходов к антибактериальной терапии. В настоящее время известен целый ряд специализированных шкал, на основании которых прогнозируется риск летального исхода и даются рекомендации по выбору места лечения. Однако стоит помнить о том, что в ряде случаев шкалы имеют свои ограничения. Так, например, получившая широкое распространение шкала PORT [22] предполагает исследование целого ряда биохимических параметров, включая мочевину, натрий, глюкозу, гематокрит, рН артериальной крови и др., что недоступно в амбулаторно-поликлинических учреждениях и большинстве стационаров РФ. Определенные перспективы для решения вопроса о месте лечения пациентов с ВП в настоящее время связывают с использованием прогностических шкал. В этом плане более предпочтительны прогностические шкалы CURB-65/CRB-65 [30]. Однако любая из прогностических шкал является только ориентиром в выборе места лечения и в каждом конкретном случае этот вопрос должен решаться лечащим врачом пациента индивидуально. Иными словами, определение места лечения больного ВП остается клиническим решением, которое не способен подменить ни один из существующих алгоритмов оценки прогноза заболевания.
Задержка с началом антибиотикотерапии более чем на 4-8 часов также является важным фактором риска неэффективности лечения [31]. В этой связи целесообразно введение первой дозы антибиотика сразу же после установления предварительного диагноза пневмонии, например, на догоспитальном этапе силами бригады скорой помощи. Необходимо обратить внимание на тот факт, что зачастую в стационарах не поддерживается необходимая преемственность лечения и нередки случаи произвольной модификации антибиотикотерапии или задержки с ее проведением при переводе больного из отделения в отделение.
Другим важным мероприятием, способным повысить эффективность лечения является оценка клинико-эпидемиологических данных, позволяющих актуализировать перечень возбудителей пневмонии (табл. 3) и, соответственно, проводить целенаправленную антибиотикотерапию.
Таблица 3. Эпидемиология и факторы риска развития ВП известной этиологии [8, 32]
| Условия возникновения | Вероятные возбудители |
| Алкоголизм | S. pneumoniae, анаэробы, аэробные грам (-) бактерии (чаще - K. pneumoniae) |
| ХОБЛ/курение | S. pneumoniae, H. influenzae, M. catarrhalis, Legionella spp. |
| Декомпенсированный сахарный диабет | S. pneumoniae, S. aureus |
| Пребывание в домах престарелых | S. pneumoniae, представители семейства Enterobacteriaceae, H.influenzae, S. aureus, C. pneumoniae, анаэробы |
| Несанированная полость рта | Анаэробы |
| Гнойничковые заболевания кожи | S. aureus |
| Эпидемия гриппа | S. pneumoniae, S. aureus, S. pyogenes, H. Influenzae реже непосредственно вирусное поражение легочной ткани |
| Предполагаемая массивная аспирация | Анаэробы |
| Развитие ВП на фоне бронхоэктазов, муковисцидоза | P. aeruginosa, B. cepacia, S. aureus |
| Внутривенные наркоманы | S. aureus, анаэробы |
| Локальная бронхиальная обструкция (например, бронхогенная карцинома) | Анаэробы |
| Иммуносупрессия (например, ВИЧ) | Рneumocystis carinii |
| Контакт с кондиционерами, увлажнителя-ми воздуха, системами охлаждения воды | L. pneumophila |
| Вспышка пневмонии среди проживающих вместе родственников | C. pneumoniae, M. pneumoniae |
| Вспышка заболевания в закрытом организованном коллективе (например, школьники, военнослужащие) | S. pneumoniae, M. pneumoniae, C. Pneumoniae |
На основании скрупулезного анализа особенностей клинического течения пневмонии в части случаев также можно предположить этиологию заболевания. Так, для пневмонии пневмококковой этиологии характерны острое начало, высокая лихорадка, боли в грудной клетке; для легионеллезной пневмонии – тяжелое течение заболевания, диарея, неврологическая симптоматика, нарушения функции печени; для микоплазменной - мышечные и головные боли, симптомы инфекции верхних дыхательных путей. Образование полостей деструкции в легких не характерно для пневмококковой, микоплазменной и хламидийной ВП, но свидетельствует в пользу стафилококковой инфекции, а также пневмонии, вызываемой аэробными грамотрицательными бактериями и анаэробами. Однако стоит помнить о том, что клинико-рентгенологические данные не могут считаться адекватными предикторами этиологии пневмонии, поскольку актуальная картина заболевания обусловлена не только (а зачастую, и не столько) своеобразием биологии того или иного возбудителя, но скорее связана с особенностями организма «хозяина» (возраст больного, наличие сопутствующих заболеваний и др.).
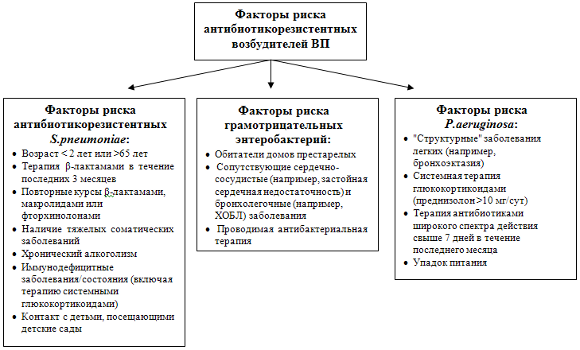
Частой причиной неэффективности лечения ВП является недооценка региональной ситуации по антибиотикорезистентности ключевых возбудителей пневмонии и отсутствие какой-либо настороженности в вопросах выявления факторов риска лекарственной устойчивости микроорганизмов (рис. 3). Важно при этом подчеркнуть, что резистентность к макролидам и фторхинолонам (ципрофлоксацин), может быть причиной терапевтической неудачи, в тоже время случаев неэффективности терапии ВП «новыми» фторхинолонами (левофлоксацин, моксифлоксацин, гемифлоксацин), обусловленной антибиотикорезистентностью, не зарегистрировано или они единичны. В этой связи стоит отметить, что с 1991 по 2005 гг. в РФ был выделен всего лишь один штамм S.pneumoniae, устойчивый к левофлоксацину (МПК > 8 мг/л), и три штамма пневмококка с умеренной резистентностью к моксифлоксацину [33].
Рисунок 3. Факторы риска выявления антибиотикорезистентных микроорганизмов
Ведение пациентов с ВП, «не отвечающей» на лечение, предполагает следующую последовательность действий:
4) перевод больного на более высокий уровень лечения (т.е. госпитализация больного в случае первоначального амбулаторного лечения или перевод пациента из отделения общего профиля в ОРИТ);
5) пересмотр тактики антибактериальной терапии;
6) проведение целенаправленного диагностического поиска.
Очевидно, что, в первую очередь, следует пересмотреть анамнестические, эпидемиологические и клинические данные, что позволит в части случаев утвердиться в альтернативной этиологии пневмонии, проанализировать известные факторы риска инфицирования полирезистентными штаммами микроорганизмов и, как следствие этого, осуществить последующую модификацию антибактериальной терапии с учетом выявленных причин терапевтической неудачи.
Безусловным подспорьем при этом могут быть результаты микробиологической диагностики (выделение культуры возбудителя и определение его чувствительности к антибиотикам), которые чаще всего доступны на 2-3 сутки от начала лечения. Впрочем, стоит заметить, что по некоторым данным целенаправленная модификация антибактериальной терапии (с учетом результатов микробиологической диагностики) характеризуется сравнимой с эмпирически назначенным лечением летальностью [34].
В отсутствии специфического микробиологического диагноза привлечение дополнительных методов инструментального (прежде всего, лучевого) и лабораторного обследования больных ВП, «не отвечающих» на лечение, способно установить причину неэффективности антибактериальной терапии в 73% случаев [3].
Экспресс-метод определения пневмококкового антигена в моче позволяет уточнить этиологию заболевания и прервать или, напротив, актуализировать (при отрицательном результате теста) поиск иных причин неэффективности лечения. Кроме этого, положительный результат теста позволит помочь в интерпретации данных микробиологической диагностики.
Перспективным является и применение иммунохроматографического теста с определения в моче растворимого антигена Legionella pneumophila серогруппы I, что позволяет без промедления изменить тактику лечения с назначением макролидов или «респираторных» фторхинолонов.
При ухудшении состояния больного и прогрессировании симптомов заболевания в обязательном порядке необходимо проводить повторные посевы крови, так как в данном случае возникает риск развития бактериемии. Несмотря на предшествующую антибиотикотерапию данное исследование имеет большую диагностическую ценность [35], так как в случае положительного результата посева крови на фоне адекватной антибактериальной терапии можно сделать вывод о наличии антибиотикорезистентных штаммов возбудителей, либо о появлении других очагов инфекции (например, эндокардит).
В последние годы все большее внимание привлекает исследование сывороточного уровня С-реактивного белка (СРБ) и прокальцитонина [36-38]. Показано, что наиболее высокая концентрация СРБ отмечается у пациентов с тяжелой пневмококковой или легионеллезной пневмонией. Уровень прокальцитонина коррелирует с тяжестью состояния пациентов с ВП и может быть предиктором развития осложнений и неблагоприятного исхода.
Следующим этапом является выявление иммунологических нарушений и последующая их коррекция, наряду с пересмотром тактики антибактериальной терапии. В настоящее время нередки случаи диагностирования пневмоцистной пневмонии (Рneumocystis jiroveci) являющейся основным клиническим проявлением у ВИЧ-инфицированных пациентов. В этой связи всем, поступающим в стационар пациентам, показан иммуноферментный анализ для обнаружения антител к ВИЧ.
В ряде случаев на фоне применения ?-лактамных антибиотиков наблюдается лекарственная лихорадка, требующая отмены антибиотика [39].
И конечно следует помнить о том, что неэффективность лечения может быть обусловлена внелегочными очагами инфекции (инфекции кожи, мочевых путей, брюшной полости, катетер-ассоциированные инфекции), в том числе нозокомиального характера, что обусловливает дальнейший диагностический поиск и микробиологическое исследование актуального материала.
В числе необходимых методов диагностики, применяемых при ведении пациентов с ВП, «не отвечающей» на лечение, стоит упомянуть компьютерную томографию органов грудной клетки и фибробронхоскопию, позволяющие заподозрить, а порой и диагностировать альтернативное пневмонии заболевание [40, 41]. Компьютерная томография помимо исключения неинфекционных заболеваний (например, бронхиолит с организующейся пневмонией) позволяет диагностировать целый ряд других причин неэффективности лечения – ограниченный плевральный выпот, абсцесс легкого и пр.
Бронхоскопия позволяет выявить ряд альтернативных патологических процессов, а микробиологическое исследование материала бронхоальвеолярного лаважа обладает большей ценностью, чем рутинное культуральное исследование мокроты. Так, например, в одном из исследований у 44% больных с ВП, «не ответившей» на лечение, этиология заболевания была установлена при бронхоскопии [42].
Конкретизированный анализ причин неэффективности лечения ВП и способов их коррекции представлен в таблице 4.
Таблица 4. Причины неэффективности лечения ВП и способы их коррекции
| Предполагаемая причина неэффективности терапии | Метод коррекции |
| Неадекватная антибактериальная терапия | Пересмотр лечения в соответствии с требованиями национальных рекомендаций |
| Предполагаемая низкая комплаентность пациента | Госпитализация больного, назначение парентеральной терапии |
| Первоначальная недооценка тяжести состояния больного | Госпитализация, перевод в ОРИТ |
| Предполагаемая лекарственная устойчивость микроорганизмов | Пересмотр терапии в пользу антибиотиков, характеризующихся низкой антибиотикорезистентностью (учет данных микробиологической диагностики) |
| Внелегочные очаги инфекции (эндокардит, менингит и пр.) | Посев крови, диагностический поиск, модификация антибактериальной терапии |
| Осложнения пневмонии (абсцесс легкого, эмпиема плевры) | Диагностика. Торакоцентез. Пересмотр тактики антибактериальной терапии с учетом актуальных возбудителей |
| Альтернативный диагноз (ТЭЛА, эндокардит трикуспидального клапана облитерирующий бронхиолит с организующейся пневмонией, системные васкулиты и пр.) | Диагностический поиск: компьютерная томография, бронхоскопия и пр. |
| Нозокомиальная суперинфекция | Своевременная диагностика, адекватная антибактериальная терапия |
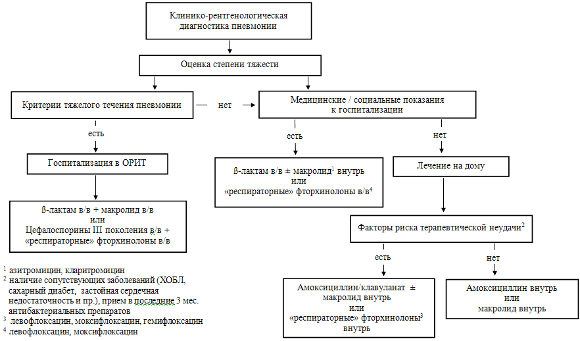
В большинстве случаев при ранней неэффективности адекватной (в соответствии с требованиями рекомендаций – рис. 4) терапии, при отсутствии у больных каких-либо известных факторов риска неэффективности, ухудшение состояния больного обусловлено исходной тяжестью состояния пациента и возможно неадекватным «ответом» организма на лечение. Каких-либо рекомендаций по возможным направлениям антибактериальной терапии в данном случае не существует, за исключением того, что комбинированная антибиотикотерапия (?-лактам+макролид) является более эффективной, чем монотерапия у пациентов с тяжелой бактериемической пневмококковой пневмонией [43, 44]. Исследования, результаты которых свидетельствовали бы о необходимости и целесообразности модификации терапии в пользу тех или иных антибиотиков в данной клинической ситуации, отсутствуют.
Рисунок 4. Алгоритм эмпирической антибактериальной терапии ВП у взрослых
Напротив, тщательный анализ анамнестических, клинических и лабораторных данных, который бы свидетельствовал о наличии факторов риска потенциально «не прикрытых» антибиотиками возбудителей ВП, обосновывает расширение эмпирической антибактериальной терапии до получения результатов диагностических исследований. Так, например, предположение о возможном инфицировании «атипичными» микроорганизмами (C. pneumoniae, M. pneumoniae, Legionella spp.) требует пересмотра тактики лечения в пользу макролидов либо «респираторных» фторхинолонов.
Очевидно, что выявление таких осложнений пневмонии, как абсцесс легкого и эмпиема плевры обусловливает необходимость назначения антимикробных препаратов, активных в отношении предсказуемых возбудителей (Klebsiella spp., Staphylococcus aureus, анаэробы).
Диагностированные иммунологические нарушения, безусловно, требуют специфической коррекции. В ряде случаев, например, при тяжелой пневмонии у лиц с предполагаемой иммуносупрессией, у пациентов с осложненным течением ВП (абсцедирование, эмпиема плевры) возможно применение препаратов IgG и IgМ для внутривенного введения, гранулоцитарного колониестимулирующего фактора (Г-КСФ) [45, 46].
У больных с тяжелой пневмонией и септическим шоком, пациентов с лейкопенией может применяться активированный дротрекогин-альфа, продемонстрировавший в клинических исследованиях снижение летальности на 9,8% [47].
При развитии острой дыхательной недостаточности (особенно у пациентов с ХОБЛ, наличие в анамнезе эпизодов венозного тромбоза, ТЭЛА) целесообразно применение низкомолекулярных гепаринов. В случае недостаточности коры надпочечников или при подозрении на таковую (предшествующий прием системных глюкокортикоидов, например пациенты с тяжелым течением ХОБЛ), а также при «рефрактерном» септическом шоке и необходимости введения высоких доз вазопрессоров применяются гидрокортизон.
Список литературы
1. Menendez R., Torres A., Zalacain R., et al. Risk factors of treatment failure in community acquired pneumonia: implications for disease outcome. Thorax 2004; 59: 960-5.
2. Barron A. Personal communication.
3. Arancibia F., Ewig S., Martinez J.A., et al. Antimicrobial treatment failures in patients with community-acquired pneumonia: causes and prognostic implications. Am J Respir Crit Care Med 2000; 162:154-60.
4. Menendez R., Torres A., Rodriguez de Castro F., et al. Reaching stability in community-acquired pneumonia: the effects of the severity of disease, treatment, and the characteristics of patients. Clin Infect Dis 2004; 39:1783-90.
5. Ewig S., de Roux A., Bauer T., et al. Validation of predictive rules and indices of severity for community acquired pneumonia. Thorax 2004; 59:421-7.
6. Roson B., Carratala J., Fernandez-Sabe N., Tubau F., Manresa F., Gudiol F. Causes and factors associated with early failure in hospitalized patients with community-acquired pneumonia. Arch Intern Med 2004; 164:502-8.
7. Niederman M.S., McCombs J.S., Unger A.N. et al. The cost of treating community-acquired pneumonia. Clin Ther 1998; 20:820-37.
8. Mandell L.A., Wunderink R.G., Anzueto A. et al. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community Acquired Pneumonia in Adults. Доступно на: http://www.thoracic.org/sections/publications/statements/pages/mtpi/idsaats-cap.html.
9. Schaaf B.M., Boehmke F., Esnaashari H., et al. Pneumococcal septic shock is associated with the interleukin-10–1082 gene promoter polymorphism. Am J Respir Crit Care Med 2003; 168:476-80.
10. Gallagher P.M., Lowe G., Fitzgerald T., et al. Association of IL-10 polymorphism with severity of illness in community acquired pneumonia. Thorax 2003; 58:154-6.
11. Wunderlink R.G., Mutlu J.M. Pneumonia. In: Enciclopedia of respiratory medicine. 2006, vol. 3. p. 402-7. The Boulevard, Landford Lane, Kidlington, Oxford, UK.
12. Daifuku R., Movahhed H., Fotheringham N., Bear M.B., Nelson S. Time to resolution of morbidity: an endpoint for assessing the clinical cure of community-acquired pneumonia. Respir Med 1996; 90:587-92.
13. Metlay J., Atlsas S., Borowsky L., Singer D. Time course of symptom resolution in patients with community-acquired pneumonia. Respiratory Medicine 1998; 92:1137-42.
14. Kuru T., Lynch J.P. Nonresolving or slowly resolving pneumonia. Clin Chest Med 1999; 20:623.
15. Roson B., Carratala J., Fernandez-Sabe N., et al. Causes and factors associated with early failure in hospitalized patients with community-acquired pneumonia. Arch Intern Med 2004; 164: 502-8.
16. Menendez R., Torres A. Risk factors for early and late treatment failure in community-acquired pneumonia [abstract]. Am J Respir Crit Care Med 2003;167:A560.
17. El-Solh A., Aquilina A., Dhillon, R., et al. Impact of invasive strategy on management of antimicrobial treatment failure in institutionalized older people with severe pneumonia. Am J Respir Crit Care Med 2002; 166:1038-43.
18. Mittl R.L. Schwab R.J., Duchin J.S., et al. Radiographic resolution of community-acquired pneumonia. Am J Respir Crit Care Med 1994; 149:630-5.
19. Almirall J., Bolibar I., Vidal J., et al. Epidemiology of communityacquired pneumonia in adults: a population-based study. Eur Respir J 2000; 15: 757-63.
20. Monton C., Torres A., El-Ebiary M. et al. Cytokine expression in severe pneumonia: a bronchoalveolar lavage study. Crit Care Med 1999; 27: 1745-53.
21. Kays M.B., Smith D.W., Wack M.E. et al. Levofloxacin treatment failure in a patient with fluoroquinolone-resistant Streptococcus pneumoniae pneumonia. Pharmacotherapy 2002; 22: 395-9.
22. Fine M.J., Auble T.E., Yealy D.M., et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. N Engl J Med 1997; 336: 243-50.
23. Kothe H., Bauer T., Marre R. Outcome of community-acquired pneumonia: influence of age, residence status and antimicrobial treatment. Eur Respir J 2008; 32:139-46.
24. Козлов С.Н. , Рачина С.А. , Домникова Н.П. и соавт. Фармакоэпидемиологический анализ лечения внебольничной пневмонии в амбулаторных условиях. Клин микроб антимикроб химиотер 2000 2(3):74-81.
25. Рачина С.А., Зайцев А.А. Фармакоэпидемиологические исследования антибактериальных препаратов при внебольничных инфекциях дыхательных путей. Глава в книге Руководство для врачей «Внебольничные инфекции дыхательных путей: диагностика и лечение», Москва 2008, ООО «М-Вести»; 254-271.
26. Рачина С.А., Козлов Р.С., Шаль Е.П. и соавт. Анализ антибактериальной терапии госпитализированных пациентов с внебольничной пневмонией в различных регионах РФ: уроки многоцентрового фармакоэпидемиологического исследования. Клин микроб антимикроб химиотер 2009; 11(1):66-78.
27. Drehobl M.A., De Salvo M.C., Lewis D.E., Breen J.D. Single-dose azithromycin microspheres vs clarithromycin extended release for the treatment of mild-to-moderate community-acquired pneumonia in adults. Chest 2005; 128(4):2230-7.
28. Agarwal G., Awasthi S., Kabra S.K., et al. ISCAP Study Group. Three day versus five day treatment with amoxicillin for non-severe pneumonia in young children: a multicentre randomised controlled trial. Br Med J 2004; 328(7443):791.
29. Pakistan Multicentre Amoxycillin Short Course Therapy (MASCOT) pneumonia study group. Clinical efficacy of 3 days versus 5 days of oral amoxicillin for treatment of childhood pneumonia: a multicentre double-blind trial. Lancet 2002; 14; 360(9336): 835-41.
30. Lim W.S., van der Eerden M.M., Laing R., et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax 2003; 58:377-82.
31. Houck P.M., Bratzler D.W., Nisa W., Ma A., Bartlett J.G. Timing of antibiotic administration and outcomes for Medicare patients hospitalized with community-acquired pneumonia. Arch Intern Med 2004; 164:637-44.
32. Чучалин А.Г., Синопальников А.И., Страчунский Л.С., и соавт. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике. – М.: OOO «Издательский дом «М-Вести»; 2006.
33. Козлов Р.С., Сивая О.В., Шпынев К.В. и др. Антибиотикорезистентность Streptococcus pneumoniae в России в 1999-2005 гг.: результаты многоцентровых проспективных исследований Пегас I и Пегас II. Клин Микробиол. Антимикроб. Химиотер 2006; 8 (1):33–47.
34. Sanial S., Smith P.R., Saha A.S., et al. Initial microbiologic studies did not affect outcome in adults hospitalized with community-acquired pneumonia. Am.J.Respir.Crit.Care Med 1999; 160:346-8.
35. Metersky M.L., Ma A., Bratzler D.W., Houck P.M. Predicting bacteremia in patients with community-acquired pneumonia. Am J Respir Crit Care Med 2004; 169:342-7.
36. Luyt C.E., Guerin V., Combes A., et al. Procalcitonin kinetics as a prognostic marker of ventilator-associated pneumonia. Am J Respir Crit Care Med 2005; 171:48-53.
37. Povoa P., Coelho L., Almeida E., et al. C-reactive protein as a marker of ventilator-associated pneumonia resolution: a pilot study. Eur Respir J 2005; 25:804-12.
38. Boussekey N., Leroy O., Alfandari S., et al. Procalcitonin kinetics in the prognosis of severe community-acquired pneumonia. Intensive Care Med 2006; 32:469-72.
39. Plouffe J.F., Breiman R.F., Fields B.S., et al. Azithromycin in the treatment of Legionella pneumonia requiring hospitalization. Clin Infect Dis 2003; 37: 1475-80.
40. Menendez R., Torres A. Treatment Failure in Community-Acquired Pneumonia. Chest 2007; 4 (vol. 132): 1348-55.
41. Feinsilver S.H., Fein A.M., Niederman M.S., et al. Utility of fiberoptic bronchoscopy in nonresolving pneumonia. Chest 1990; 98:1322-6.
42. Ortqvist A., Kalin M., Lejdeborn L., Lundberg B. Diagnostic fiberoptic bronchoscopy and protected brush culture in patients with community-acquired pneumonia. Chest 1990; 97: 576-82.
43. Waterer G.W., Somes G.W., Wunderink R.G. Monotherapy may be suboptimal for severe bacteremic pneumococcal pneumonia. Arch Intern Med 2001; 161:1837-42.
44. Martinez J.A., Horcajada J.P., Almela M., et al. Addition of a macrolide to a b-lactam–based empirical antibiotic regimen is associated with lower in-hospital mortality for patients with bacteremic pneumococcal pneumonia. Clin Infect Dis 2003; 36:389-95.
45. Lissner R., Struff W.G., Autenrieth I.B., et al. Efficacy and potential clinical applications of Pentaglobin and IgM entriched immunoglobulin concetrate suitable for intravenosus infusion. Eur J Surg 1999; 584:17-25.
46. Nelson S., Farkas S., Fotheringham N., et al. Filgrastim in the treatment of hospitalized patients of communityacquired pneumonia (CAP) [abstract] Am J Respir Crit Care Med 1996; 153.
47. Ely E.W., Laterre P.F., Angus D.C., et al. Drotrecogin alfa (activated) administration across clinically important subgroups of patients with severe sepsis. Crit Care Med 2003; 31:12-9.