К метаболическому синдрому (МС), олицетворяющему в настоящее время одну из наиболее приоритетных и социально-значимых проблем медицины, приковано пристальное внимание широкого круга специалистов во всем мире: эндокринологов, кардиологов, терапевтов, врачей общей практики и др. Это обусловлено в первую очередь как высокой распространенностью данного синдрома, которая в некоторых странах, в том числе и России, приобретает характер эпидемии, достигая 25–35% и выше среди взрослого населения, так и большим клиническим значением. С одной стороны, это состояние является обратимым, т.е. при соответствующем лечении можно добиться уменьшения выраженности основных его проявлений, с другой – оно предшествует возникновению сахарного диабета (СД) типа 2 и болезней, в основе которых лежит атеросклероз (ишемическая болезнь сердца – ИБС, инфаркт миокарда, церебральный инсульт), являющихся в настоящее время основными причинами повышенной смертности. Таким образом, все заметнее начинает прослеживаться сопряженность прогрессии МС и показателей общей смертности и смертности от сердечно-сосудистых заболеваний.
Представление о МС было в основном сформировано более 50 лет назад. Однако в качестве своего рода точки отсчета современных научных представлений принят 1988 г., когда G.Reaven описал симптомокомплекс, включавший гиперинсулинемию, нарушение толерантности к глюкозе, гипертриглицеридемию, низкий уровень холестерина (ХС) липопротеинов высокой плотности (ЛПВП) и артериальную гипертензию, под названием «синдром X». Им же впервые была выдвинута гипотеза о том, что нарушения, объединенные в рамках синдрома, связаны единым происхождением – инсулинорезистентностью и компенсаторной гиперинсулинемией, а также отмечена важность описанных изменений как своеобразной «предтечи» сердечно-сосудистых заболеваний, оказывающих наиболее отрицательное влияние на продолжительность и качество жизни современного человека в индустриально развитом обществе, способствуя, прежде всего, развитию ИБС. Крайне важным для оценки состояния проблемы явилось то, что G.Reaven отнес абдоминальное ожирение к числу обязательных признаков синдрома. Указанным критериям не противоречит предложение J.Kaplan, который, вводя в 1989 г. понятие «смертельный квартет», определил абдоминальное ожирение, наряду с нарушением толерантности к глюкозе, артериальной гипертензией и гипертриглицеридемией, в качестве облигатной составляющей синдрома. Более поздние работы G.Reaven и других исследователей показали и подтвердили тесную связь абдоминального ожирения с инсулинорезистентностью, другими гормональными и метаболическими нарушениями (в частности, гиперурикемией), которые в большинстве своем являются факторами риска развития СД типа 2 и атеросклеротических и дисметаболических заболеваний [1]. Клиническое значение метаболических и гормональных нарушений, объединенных в рамках синдрома, обусловлено тем, что их сочетание резко ускоряет развитие и прогрессирование сердечно-сосудистых заболеваний, занимающих 1-е место среди причин смертности населения индустриально развитых стран.
В 1998 г. решением рабочей группы Всемирной организации здравоохранения (ВОЗ) дано определение «МС Х» как комплексу метаболических и гемодинамических нарушений, основным клиническим проявлением которого является резистентность к инсулину с гиперинсулинемией, снижением толерантности к углеводам и возможным СД типа 2, дислипидемией (гипертриглицеридемией, снижением ЛПВП), нарушением гемостаза (склонность к тромбообразованию), артериальной гипертонией, а также висцеральным ожирением.
Утвержденные новые критерии предусматривают более широкое выявление этого синдрома. Показано, что у таких пациентов и в плане развития тяжелой сердечно-сосудистой патологии и летального исхода прогноз неблагоприятный. Показатели смертности у них в 2–3 раза выше, чем в общей популяции. Важно, что в американских критериях первой нозологической формой, развивающейся на фоне изменения лабораторных и клинических показателей, является НАСГ. В настоящее время для диагностики МС используются новые критерии, принятые Международной диабетической ассоциацией в апреле 2005 г. Они подразумевают более «жесткие» показатели по ожирению и уровню гипергликемии натощак:
- абдоминальное ожирение (окружность талии – мужчины >94 см, женщины >80 см);
- триглицериды >1,7 ммоль/л (150 мг/дл) ХС ЛПВП – мужчины <1,0 ммоль/л, женщины <1,2 ммоль/л;
- АД >130/85 мм рт. ст.;
- гликемия >5,6 ммоль/л или нарушение толерантности к глюкозе (НТГ).
До настоящего времени дискутируется причинность метаболических нарушений в патогенезе синдрома Х. Одни авторы считают, что наследственная предрасположенность к инсулинорезистентности и ожирению в сочетании с низкой физической активностью и избыточным питанием определяет развитие ожирения и тканевой инсулинорезистентности и как следствие этого – компенсаторной гиперинсулинемии. Гиперинсулинемия сначала снижает чувствительность, а затем и блокирует инсулиновые рецепторы, вследствие чего поступающие с пищей глюкоза и жиры депонируются жировой тканью. Это еще больше усиливает инсулинорезистентность. С другой стороны, гиперинсулинемия подавляет распад жиров, что способствует прогрессированию ожирения. Образуется порочный круг. Постоянная гиперинсулинемия истощает секреторный аппарат ?-клеток поджелудочной железы, что приводит к нарушению толерантности к глюкозе. Существует и другая гипотеза, которая предполагает, что центральный тип ожирения алиментарного генеза является причиной инсулинорезистентности, гиперинсулинемии и других метаболических нарушений. Адипоциты висцеральной жировой ткани секретируют свободные жирные кислоты непосредственно в воротную вену печени. Их высокие концентрации подавляют поглощение инсулина печенью, что приводит к гиперинсулинемии и относительной инсулинорезистентности.
Весьма важным представляется выделение группы ранних признаков МС, которые с высокой вероятностью свидетельствуют о наличии нарушений обмена веществ, трансформируемых в ближайшем будущем в известные клинические компоненты «смертельного квартета». Выявлены корреляции между инсулинорезистентностью и нарушениями системы гемостаза. Установлена частая взаимосвязь нарушений липидного и углеводного обмена, обусловленных инсулинорезистентностью, с гастроэнтерологическими заболеваниями прежде всего с неалкогольной жировой болезнью печени (НАЖБП), хроническим панкреатитом, язвенной болезнью.
Распространенность неалкогольной жировой болезни печени в различных странах Европы составляет 10–24% в общей популяции населения, 57–74% – среди тучных людей и приблизительно 11% – у пациентов, которым проводят биопсию печени в связи с повышенным уровнем трансаминаз сыворотки крови [11]. В действительности распространенность НАЖБП может быть еще выше среди больных без клинической симптоматики, не употребляющих алкоголь в значительных количествах, если при этом отсутствуют серологические маркеры вирусных гепатитов. Так, многие больные с повышенной активностью печеночных ферментов в крови и отрицательными результатами неинвазивных исследований могут иметь неалкогольный стеатогепатит (НАСГ). Есть сообщения о случаях НАЖБП, выявляемых в возрасте 10–20 лет [5]. Так, в странах Евросоюза он обнаруживается у 2,6% детей, в то время как у детей с избыточной массой тела – в 22,5–52,8% случаев.
Между тем актуальность изучения неалкогольного стеатоза (НАС) связана, прежде всего, с высокой вероятностью трансформации последнего в НАСГ с последующим переходом в фиброзные изменения и цирротическим перерождением. Связь между стеатозом, НАСГ и развитием фиброза изучена недостаточно. Механизм трансформации стеатоза в НАСГ включает ряд патогенетических звеньев, идентичных как при алкогольном, так и неалкогольном поражении. НАСГ – самостоятельная нозологическая единица, для которой характерны повышение активности ферментов печени в крови и морфологические изменения в биоптатах печени, подобные изменениям при алкогольном гепатите; однако больные с НАСГ не употребляют алкоголь в количествах, способных вызывать повреждение печени. Основными проявлениями МС, ассоциированными с НАСГ, являются ожирение, СД типа 2 и гиперлипидемия, диагностируемая у 20–80% больных c НАСГ. Нередко при стеатозе печени, развивающемся на фоне СД, наблюдаются нарушения со стороны желчевыделительной системы, реализующиеся развитием хронического холецистита, дискинезии желчного пузыря, желчно-каменной болезни.
Принято считать, что чаще всего (в 69–100% случаев) НАСГ сочетается с ожирением [1, 3, 10, 14, 16]. Масса тела большинства таких больных превышает идеальную на 10–40% [1, 2, 10, 14, 15]. В случае превышения массы тела на 10–20% риск возникновения СД типа 2 на 44% выше, чем у людей, имеющих нормальную массу тела. Абдоминальный тип ожирения является наиболее характерным атрибутом развития НАС и НАСГ. Его особенность заключается в том, что при нем активно протекают метаболические процессы. Это обусловлено высокой плотностью рецепторов к катехоламинам, соматотропному гормону, половым гормонам, гормонам щитовидной железы и малым количеством рецепторов к инсулину. Низкая концентрация рецепторов инсулина в абдоминальной жировой ткани способствует повышению продукции свободных жирных кислот, увеличению уровня триглицеридов сыворотки крови и закономерному развитию процесса атерогенеза. В свою очередь, необходимо отметить, что жировая ткань является своеобразным эндокринным органом и секретирует значительное количество гормонов, многие из которых прямо или опосредованно влияют на инсулиновую резистентность и, естественно, на эффективность проводимой терапии. Данный факт имеет прямое влияние на развитие и скорость прогрессирования патологических изменений в печени. Так, установлено, что чувствительность к инсулину снижается более чем на 40% при превышении индивидуумом идеальной массы тела на 35–40%.
В то же время, по разным данным, в 2,7–9% НАСГ наблюдается у людей с нормальной массой тела, а B.Bacon и соавт. [13] выявили ожирение всего у 39% больных с НАСГ. В большинстве случаев степень ожирения не коррелирует со степенью жирового гепатоза [1]. Кроме того, быстрая потеря массы тела (повышенная мобилизация свободных жирных кислот СЖК из жировых депо), а также формирующийся при этом синдром мальабсорбции (дефицит поступления пищевых факторов: метионина, холина, необходимых для синтеза лецитина) тоже имеют важное патогенетическое значение для формирования НАСГ. Накопление жира в ткани печени (в гепатоцитах, а также звездчатых клетках) в данном случае может быть следствием повышения поступления СЖК в печень, снижения скорости ?-окисления СЖК в митохондриях печени, снижения синтеза или секреции липопротеинов очень низкой плотности. Таким образом, НАСГ может прогрессировать в цирроз печени, приводить к печеночно-клеточной недостаточности и даже гепатоцеллюлярной карциноме. Популяционные исследования позволяют предположить, что около 80% криптогенных циррозов печени являются исходами НАСГ.
В то же время распространенность НАЖБП, соотношение ее форм (прежде всего цирротической и нецирротической) в популяции, а также значимость факторов риска в развитии заболевания является предметом многочисленных дискуссий. В свою очередь именно эти нерешенные вопросы предопределили цели и задачи выполненного исследования согласно протоколу DIREG_L_01903.
В течение 2007 года было проведено открытое, многоцентровое (208 центров в России) проспективное исследование-наблюдение, целью которого явилась - оценка распространенности НАЖБП среди пациентов, обращающихся к терапевтам поликлиник, а также определение значимости факторов риска развития НАЖБП
Материалы и методы
В исследовании участвовали 30754 пациентов в возрасте 18-80 лет, приходящие на прием к терапевтам поликлиник независимо от причины обращения (с явными признаками заболевания печени или с отсутствием таковых).
Критериями исключения были:
- Беременность
- Пациенты, категорически отказавшиеся от участия в программе
- Участие в других клинических исследованиях
В программе приняли участие 17208 (56,0%) женщин и 13209 (43,0%) мужчин, средний возраст которых составил 47,8 ± 16,4 лет. По возрастным группам пациенты распределилась следующим образом (рис.1). Наибольшее число пациентов вошло в следующие возрастные группы 40 - 49 лет (6520 (21,2%) пациентов), 50 – 59 лет (6469 (21,0%) пациентов) и 18 – 29 лет (5158 (16,8%) пациентов).
Рис.1 Распределение пациентов по возрастным группам
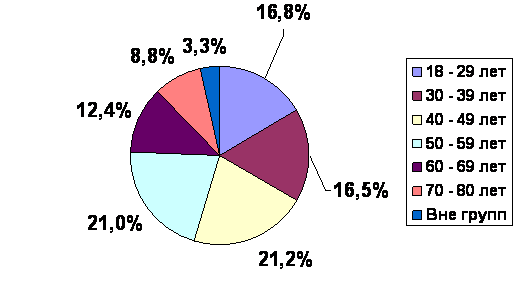
Рис.2 Распространенность НАЖБП среди пациентов, обращающихся к терапевтам поликлиник
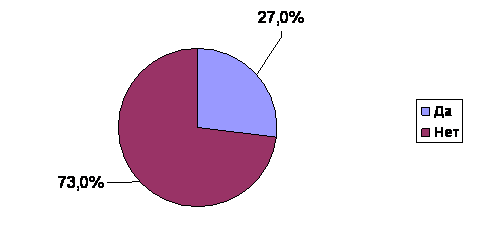
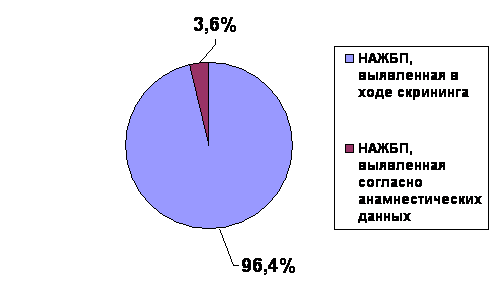
Среди всех включённых в анализ пациентов НАЖБП была отмечена у 8315 (27,0%) (рис.2). При этом в ходе скрининга НАЖБП на нецирротической стадии процесса была выявлена у подавляющего числа пациентов - 8018 (96,4% от числа больных НАЖБП). В популяцию пациентов, у которых НАЖБП была выявлена согласно анамнестических данных, вошло 297 (3,6%) пациентов (рис.3). Таким образом, исследование еще раз подтвердило необходимость целенаправленного обследования пациентов для верификации диагноза НАЖБП в виду маломанифестного течения заболевания.
Рис.3 Выявляемость НАЖБП по данным анамнеза и в результате скрининга
Стеатоз был диагностирован у 6680 (80,3%) пациентов, стеатогепатит у 1398 (16,8%) пациентов и цирроз был отмечен у 237 (2,9%) пациентов (рис.4).
Рис.4 Структура НАЖБП среди пациентов, обращающихся к терапевтам поликлиник
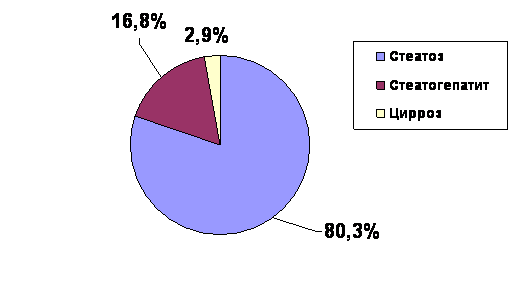
В ходе скрининга стеатоз регистрировался у 6406 (77,0% от числа больных НАЖБП) пациентов, по анамнестическим данным стеатоз был выявлен у 253 (3,0%). Стеатогепатит в ходе скрининга был выявлен у 1375 (16,5%) пациентов и у 44 (0,5%) стеатогепатит был выявлен по анамнестическим данным.
В популяции НАЖБП заболевание на нецирротической стадии наблюдалось у большинства (8078 (97,1%)) пациентов. Заболевание на цирротической стадии наблюдалось у 237 (2,9%) пациентов.
Анализ распространённости НАЖБП в возрастных группах показал, что чаще всего НАЖБП была отмечена у пациентов следующих возрастных групп: 50 – 59 лет (2582 (31,1% от числа больных НАЖБП) пациента), 40 – 49 лет (1960 (23,6%) пациентов), 60 – 69 лет (1508 (18,1%) пациентов) (табл.1).
Таблица 1. Распространённость НАЖБП в возрастных группах и популяциях
| Популяция | Всего (N = 30754) | |
| 18 - 29 лет | 287 (3,5%) | 287 (0,9%) |
| 30 - 39 лет | 691 (8,3%) | 691 (2,2%) |
| 40 - 49 лет | 1960 (23,6%) | 1960 (6,4%) |
| 50 - 59 лет | 2582 (31,1%) | 2582 (8,4%) |
| 60 - 69 лет | 1508 (18,1%) | 1508 (4,9%) |
| 1014 (12,2%) | 1014 (3,3%) |
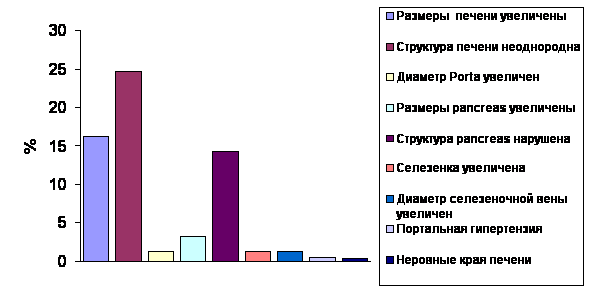
В настоящее время необходимо констатировать факт, что ультразвуковое исследование (УЗИ) является одним из основных инструментальных исследований для скрининговой диагностики НАЖБП. Не смотря на то, что гистологическое исследование биоптата является «золотым» стандартом диагностики НАЖБП, неинвазивность процедуры, а также увеличение разрешительной способности УЗИ помогает врачу поликлиники при постановке предварительного диагноза с целью последующей верификации этиологического фактора. Так в исследовании у пациентов с НАЖБП наиболее часто встречающимися УЗ-признаками были увеличение размеров печени и изменение ее структуры (рис.5). Примечательным является факт выявления изменений структуры поджелудочной железы у значительной части пациентов с НАЖБП, что указывает на вовлечение в патологический процесс двух основных органов, принимающих участие в регуляции липидного и углеводного видов обмена.
Рис.5 Результаты УЗИ печени, поджелудочной железы и селезенки
В таблице 2 представлены данные о распространённости факторов риска. В популяции пациентов, вошедших в анализ, самыми распространёнными факторами риска были артериальная гипертензия – 12864 (41,8%) пациента, дислипидемия – 11573 (37,6%) пациента и абдоминальное ожирение – 11045 (35,9%) пациентов. Также был выполнен анализ на всех пациентах в зависимости от наличия НАЖБП, в ходе которого была установлена значимость всех анализируемых факторов риска (p-величина: < 0.001). Так в популяции НАЖБП чаще других отмечались дислипидемия – 6311 (75,9%) пациентов, артериальная гипертензия – 5813 (69,9%) пациентов и гиперхолестеринемия 5717 (68,8%) пациентов. При этом коррелятивная связь возрастала по мере увеличения степени артериальной гипертензии и выраженности дислипидемии либо гиперхолестеринемии.
Таблица 2. Факторы риска - распространенность в популяции и группе с НАЖБП
| Заболевание | Популяция НАЖБП (N = 8315) | Всего (N = 30754) |
| Абдоминальнное ожирение | 4671 (56,2%) | 11045 (35,9%) |
| Абдоминальнное ожирение, мужчины | 1464 (17,6%) | 3075 (10,0%) |
| Абдоминальнное ожирение, женщины | 3207 (38,6%) | 7970 (25,9%) |
| Ожирение | 4508 (54,2%) | 7328 (23,8%) |
| Ожирение: степень 1 | 2750 (33,1%) | 4827 (15,7%) |
| Ожирение: степень 2 | 1324 (15,9%) | 1869 (6,1%) |
| Ожирение: степень 3 | 434 (5,2%) | 632 (2,1%) |
| Диабет 1-го типа | 99 (1,2%) | 154 (0,5%) |
| Диабет 2-го типа | 1922 (23,1%) | 2755 (9,0%) |
| Гипергликемия | 1723 (20,7%) | 2569 (8,4%) |
| Женщины в возрасте 45 - 55 лет | 1596 (19,2%) | 4019 (13,1%) |
| Артериальная гипертензия | 5813 (69,9%) | 12864 (41,8%) |
| 1385 (16,7%) | 3525 (11,5%) | |
| Артериальная гипертензия, степень 2 | 3416 (41,1%) | 7372 (24,0%) |
| Артериальная гипертензия, степень 3 | 714 (8,6%) | 1297 (4,2%) |
| Заболевания ССС кроме АГ | 2321 (27,9%) | 5445 (17,7%) |
| Дислипидемия | 6311 (75,9%) | 11573 (37,6%) |
| Гипертриглицеридемия | 3908 (47,0%) | 6482 (21,1%) |
| Пониженный уровень ЛВП | 1478 (17,8%) | 2445 (8,0%) |
| Гиперхолестеринемия | 5717 (68,8%) | 10291 (33,5%) |
Обсуждение
Одной из наиболее актуальных проблем современной клинической медицины является проблема метаболического синдрома и ассоциированных с ним заболеваний [4]. Однако до настоящего времени не определены основные детерминанты этих состояний, но многими авторами выделяется ведущая роль нарушений углеводного обмена [7]. Наиболее значимыми из них являются нарушение функциональной активности гликолиза и развитие инсулинорезистентности.
В плане формирования метаболического синдрома большое значение придается органам и тканям, участвующим в углеводном обмене и в особенности печени – главном органе глюконеогенеза. При этом печень является не только ”колыбелью” метаболических расстройств, но и мишенью этих нарушений, одним из основных морфологических проявлений которых является избыточное отложение жира в гепатоцитах. В последующем происходит изменение функциональной активности клеток печени и комплексная перестройка регуляции гомеостаза, способствующая развитию патоморфологических изменений в начале по типу дистрофии и крупнокапельного ожирения, а в дальнейшем - воспаления и фиброза.
Таким образом пищеварительный тракт является своеобразной ареной сражения, где уже на ранних стадиях развертываются основные патогенетические механизмы формирования компонентов МС. Морфогенез разных заболеваний, связанных с патологией липидного обмена, во многом обусловлен нарушениями взаимодействия гепатоцитов с обеспечивающей его функции системой синусоидальных клеток и нарушением кооперативных связей в самой этой системе. Патология билиарного тракта у больных с МС составляет 41,9%, патология «второго сердца» – печени – 64%. Именно печень является одним из главных органов-мишеней при МС. Наибольшее значение для клинической практики имеет факт многочисленных патогенетических параллелей между развитием МС и НАСГ. Пациенты с МС имеют максимальный риск развития жировой болезни печени и как следствие – стеатогепатита, который выявляется в 37,5% случаев. Возможность развития патологических изменений печени у пациентов, страдающих МС, описана давно. Отражением этого стало появление в клинической практике терминов «диабетический гепатоз» и «жировой гепатоз». Еще в 1884 г. Frerichs изучал изменения, происходящие в печени у больных с «сахарной болезнью», а в 1970-х годах постулировался факт возможной трансформации жировой дистрофии печени в цирроз.
Таким образом в настоящее время НАЖБП расценивается как печеночное проявление метаболического синдрома, ключевым моментом которого считается инсулинорезистентность.
Существует два основных представления об отправных точках патогенеза СГ и НАСГ. Первая предполагает, что в его основе лежит нарушение углеводного обмен (инсулинорезистентность), а вторая – жирового обмена (развитие абдоминального ожирения и дислипопротеидемия). Некоторые исследователи полагают, что развитие СГ и НАСГ обусловлено существованием одного ("мажорного") или группы взаимодействующих между собой генов, которые могут одновременно стимулировать, в том числе и развитие всех компонентов МС. В результате анализа проведенного исследования мы пришли к выводу, что в своем дебюте СГ необходимо рассматривать как адаптивную реакцию организма на воздействие хрониостресса с формированием, прежде всего нарушений липидного обмена. Присоединяющиеся в последствии нарушения углеводного обмена не только способствуют прогрессии МС и НАЖБП, но и предопределяют срыв адаптивной реакции в виде развития воспалительно-фибротических изменений. Однако выделение ведущих звеньев патогенеза заболевания открывают дополнительные возможности для проведения целенаправленной профилактики и эффективного лечения как НАЖБП, так и МС в целом.
Участие сразу нескольких факторов в формировании и прогрессии НАЖБП предполагает комплексность в лечебной тактике с целью достижения оптимального эффекта. Однако использование эссенциальных фосфолипидов в комплексе с коррекцией микробно-тканевого комплекса кишечника можно рассматривать в настоящее время как один из базисных вариантов терапии НАЖБП. Встраиваясь в плазматические мембраны, фосфолипиды, обогащенные полиненасыщенными жирными кислотами меняют функционирование интегральных белков. При любой конформации ненасыщенных ЖК невозможно обеспечить их столь же плотную упаковку, как насыщенных. Наличие в кислоте второй двойной связи в еще большей степени снижает плотность конформационной упаковки. Площадь, занимаемая в монослое одной молекулой фосфатидилхолина, резко увеличивается при замене в первом положении насыщенной ЖК даже на мононенасыщенную. Полиненасыщенные фосфолипиды способствуют активной конформации интегральных белков. Распределение в мембране полиненасыщенных фосфолипидов неоднородно. Избирательно обогащены ими анулярные фосфолипиды, которые непосредственно прилежат к интегральным белкам и окружают их. Это позволяет считать, что полиненасыщенные фосфолипиды в биомембранах встраиваются именно в анулярные слои, модулируя, таким образом, работу рецепторного аппарата, собственно, чем и можно объяснить позитивный эффект Эссенциале на углеводный обмен.
Механизм действия и обоснование терапевтического применения эссенциальных фосфолипидов частично связаны с их влиянием на состояние системы эйкозаноидов. Полиненасыщенные жирные кислоты (ПНЖК) эссенциальных фосфолипидов, являются конкурентными антагонистами арахидоновой кислоты — основного субстрата синтеза простагландинов (ПГ), тромбоксанов (Тх) и лейкотриенов (ЛТ) в организме в составе фосфолипидов клеточных мембран.
Воздействие рекомендуемого терапевтического комплекса на состояние углеводного обмена носит как минимум двойственный характер. Опыт использования в клинике терапии усовершенствования врачей Военно-медицинской академии у пациентов с НЖБП в комбинированной терапии эссенциальных фосфолипидов и пребиотика позволяет говорить не только об улучшении функционального состояния гепатоцитов, но и оптимизации липидного и углеводного видов обмена. Данный факт имеет огромное значение, если учитывать длительность терапии больных НАСГ, которая должна определяться не только купированием цитолитического синдрома, но и продолжаться до достижения регресии степени стеатоза печени.
Выводы
В связи с субклиническим течением НАЖБП, в особенности неалкогольный стеатоз, только 1% пациентов, обращающихся к терапевтам поликлиник по разным поводам, знают об имеющейся у них НАЖБП. Остальные почти 26% о своем заболевании и не подозревают.
Анализ распространенности НАЖБП в зависимости от возраста показал, что в возрастном диапазоне от 30 до 40 лет отмечается резкий подъем частоты встречаемости НАЖБП, который имеет также выраженный характер у пациентов 40-50 лет, а затем удерживается на наиболее высоком уровне (39.9% - 37,7%) практически стабильно у пациентов старше 50 лет.
Факторы риска НАЖБП требуют детального изучения. Полученные данные показывают превалирование нарушений липидного и углеводного обмена и артериальной гипертензии, что укладывается в рамки метаболического синдрома, доказывая патогенетическую связь метаболических нарушений и НАЖБП
Литература
1. Адашева Т.В. Метаболический синдром – основы патогенетической терапии. Леч. врач. 2003; 10: 5–7
2. Алмазов В.А., Благосклонная Я.В., Красильникова Е.И. Использование эссенциальных фосфолипидов в лечении больных ишемической болезнью сердца и инсулиннезависимым сахарным диабетом. Кардиология. 1996; 1: 30–3.
3. Блюгер А.Ф., Новицкий И.Н. Практическая гепатология. Рига: Звайне, 1984.
4. Винницкая Е.В., Шепелева С.Д., Шулятьев И.С. Неалкогольный стеатогепатит в клинике хронических заболеваний печени. Экспер. и клин. гастроэнтерол.. 2003; 1: 123.
5. Ивашкин В.Т. Настоящее и будущее клинической гепатологии. В.Т.Ивашкин, А.О. Буеверов. Рус. мед. журн. 2002. .4,(1): 13–5.
6. Ивашкин В.Т., Шульпекова Ю.О. Неалкогольный стеатогепатит. Рус. мед. журн. 2000; 2 (2): 41–3.
7. Клинико-морфологическая диагностика хронических заболеваний печени в сочетании с патологией сердечно-сосудистой системы. Методические рекомендации по теме НИР 4.99.241.п. 12). СПб., 2000.
8. Лазебник Л.Б. и др. Клинико-морфологические изменения печени при атерогенной дислипидемии и при лечении статинами. Тер. арх. 2003; 75 (8): 51–4.
9. Морозов И.А. Метаболические аспекты морфогенеза липидных включений в печени. Экспер. и клин. гастроэнтерол. 2003; 1: 60–4.
10. Оганов Р.Г., Перова Н.В., Метельская В.А. Сочетание компонентов метаболического синдрома связано с высоким риском атеросклеротических заболеваний. Кардиоваск. тер. и проф. 2004; 1: 56–9.
11. Подымова С.Д. Болезни печени. М.: Медицина, 1993.
12. Angulo P, Reach JC, Baits KP. Independent predictors of liver fibrosis with nonalcoholic steatohepatitis. Hepatology 1999; 30: 1356–62.
13. Bacon BR, Farahvash MJ. Nonalcoholic steatohepatitis: an expanded clinical entity. Gastroenterology 1994; 107 (7): 1103–9.
14. Baker AL, Jaspan JB, Haines NW. A randomized clinical trial of insulin and glucagon infusion for treatment of alcoholic hepatitis: progress report in 50 patients. Gastroenterology 1989; 80 (9): 1410–14.
15. Leuschner U, James OFW, Dancygier H. Steatohepatitis (NASH and ASH): Springer, 2004.
16. Ludwig J et al. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc 1980; 55: 434–8.
17. Muriel P, Mourelle M. Prevention by silimarin of membrane alterations in acute CCl4 liver damage. J Appl Toxicol 1990; 10: 275–9.
18. Reaven GM. Diabetes 1988; 37: 1595–607.