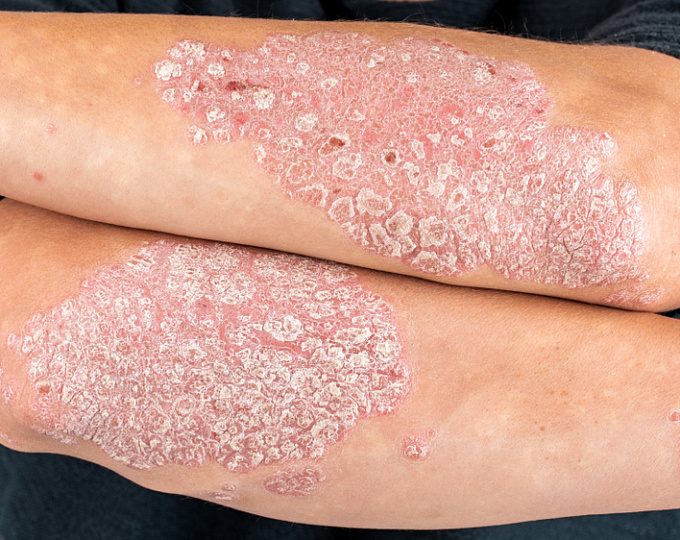
US Food and Drug Administration (FDA) одобрило препарат бимекизумаб для лечения бляшечного псориаза умеренной или тяжелой степени у взрослых пациентов.
Препарат представляет собой ингибитор интерлейкина 17A и интерлейкина 17F.
Бимекизумаб доступен в форме шприцов для самостоятельных инфекций. Доза составляет 320 мг (2 подкожные инъекции по 160 мг) на 0 неделе и затем на 4, 8, 12 и 16 неделях и затем каждые 8 недель. Для пациентов с весом 120 кг и более рекомендованная доза составляет 320 мг каждые 4 недели после 16 недель.
Эффективность
- Одобрение препарата стало возможно после получения положительных результатов 3 рандомизированных плацебо-контролируемых исследований 3 фазы.
- Показано, что более 8 из 10 пациентов достигли снижения тяжести заболевания на 90% и более на 16 неделе, оцениваемой по PASI 90.
- Более, чем у 70% пациентов улучшение на 75% (PASI 75) было отмечено на 4 неделе.
Анализ безопасности
- Наиболее частыми побочными эффектами (менее 1% случаев) выступали инфекции верхних дыхательных путей, оральный кандидоз, головная боль, инфекция. вызванная тинеа, гастроэнтерит, инфекция простого герпеса, акне, фолликулит, усталость и инфекции в месте инъекции.
- FDA также предупреждает, что на фоне терапии бимекизумабом потенциально повышается риск суицидальных мыслей/поведения, но причинно-следственная связь между ними не установлена. Учитывая этот риск следует оценивать потенциальное ухудшение депрессии/суицидальных мыслей на фоне терапии.
Источник: Marcia Frellick. FDA Approves Bimekizumab for Moderate to Severe Plaque Psoriasis in Adults. Medscape. October 18, 2023.