Хорошо известно, что ревматоидный артрит (РА) является хроническим заболеванием соединительной ткани с прогрессирующим эрозивно-деструктивным поражением преимущественно периферических суставов (в ряде случаев с развитием васкулита и поражением кожи, мышц, внутренних органов и систем).
Терапия РА – «поле» для активной конкуренции ряда лекарственных препаратов. Среди общих принципов лечения особое место занимает длительно проводимая базисная терапия, воздействующая на иммунные процессы. Проделав небольшой исторический экскурс в становление этого направления можно выделить два краеугольных камня: начатое в 1980г. широкое использование метотрексата и введение в клиническую практику в 2000г. биопрепаратов – ингибиторов фактора некроза опухоли-α (ФНО-α) [1]. Последнее стало возможным, благодаря «тонкому» изучению моноклональных антител, регуляторных белков и их рецепторов, а также ингибиторов этих структур.
Биологические агенты показали свою высокую эффективность в ведении пациентов с РА, что проявляется в предотвращении структурных повреждений, значимом увеличении трудоспособности и повышении качества жизни. Данное лечение обеспечивается систематическим внутривенным или подкожным введением биоагентов в течение нескольких недель или месяцев. Однако у 30 – 50% больных отсутствует клинический ответ [2].
В связи с этим, поиски эффективных лекарственных препаратов продолжаются. Так, были синтезированы химические молекулы с молекулярной массой менее 1кДа для перорального приема, известные как малые молекулы, которые ингибируют работу внутриклеточных сигнальных систем. Внутриклеточный сигнальный путь опосредует ответ клетки на стимулы окружающей среды путем проведения и усиления сигналов, инициированных при связывании лигандов с рецепторами клеточной мембраны. Блокирование «сигнальной сети» может приводить к значимому снижению продукции цитокинов и других воспалительных медиаторов.
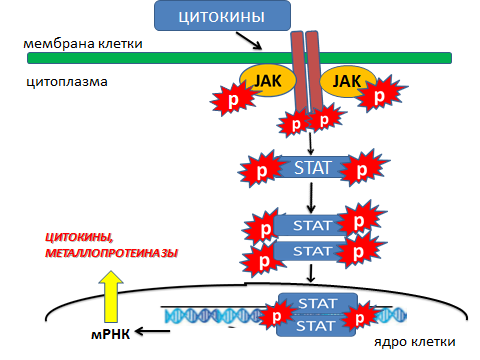
Среди таких многообещающих терапевтических агентов особое место занимают ингибиторы янус-киназ (janus kinases - JAKs). Оказалось, что семейство янус-киназ (JAK1, JAK2, JAK3 и тирозин киназа 2 -Tyk2), а также семейство STAT (signal transducer and activator of transcription) факторов транскрипции играют ключевую роль в цитокин-опосредованном преобразовании внутриклеточных сигналов [1,3].
Наглядность этого пути можно представить следующим образом (см. рис). Связывание цитокина с мембранным рецептором клетки приводит к активации янус-киназы JAK, чем запускаются процессы аутофосфорилирования. Затем JAK участвует в фосфорилировании самого мембранного рецептора, способствуя соединению STAT-белков с гомологичным доменом фосфорилированного рецептора клеточной мембраны. Результатом этого является активация фосфорилирования STAT-белков ферментной системой янус-киназ. Фосфорилированные STAT-белки димеризуются и транслоцируются в ядро для регуляции экспрессии генов. Таким образом, последовательный каскад фосфорилирования приводит к активации транскрипционных факторов, индуцирующих синтез цитокинов или металлопротеиназ, поддерживающих процессы воспаления [3].
Интересно, что JAK-киназы получили свое название в честь мифического римского божества Януса двуликого, так как содержат два киназных домена, но лишь С-терминальный проявляет тирозинкиназную активность.
Рисунок. JAK/STAT внутриклеточный сигнальный путь (адаптировано по M. Gema Bonilla-Herna et al)
Тофацитиниб – первый ингибитор янус-киназ 1/3 типов (JAK-1/3). JAK-1/3 типов связана с общей гамма-цепью комплекса 1 типа цитокиновых рецепторов (IL-2R, IL-4R, IL-7R). Эти рецепторы необходимы для активации Т-клеток, а мутации в JAK-3 приводят к тяжелому Т-клеточно-опосредованному иммунодефициту.
Предпосылками к клиническому исследованию препарата стали данные, полученные на моделях животных. Впервые эффективность тофацитиниба была продемонстрирована на модели мышей при трансплантации сердца, где активация Т-клеточно-опосредованных реакций является решающей в развитии отторжения трансплантата [4].
Кроме этого, янус-киназы ассоциированы с рецепторами других цитокинов: ИЛ-6, ИНФ 1 типа, ИЛ 12 и др. Ряд цитокинов воздействует на различные типы клеток, вовлеченных в патогенез РА: клетки, происходящие из моноцитов (макрофаги, дендритные клетки, остеокласты) и происходящие из мезенхимы (остеобласты, хондроциты, синовиоциты). В связи с этим, сочетание ингибирования JAK-1 и JAK-3 (и в меньшей степени JAK-2 и TYK-2) при применении ингибиторов янус-киназ приводит к противовоспалительному и костно-протективному эффектам, о чем свидетельствуют исследования на модели грызунов [1].
Клинические исследования по эффективности и безопасности применения тофацитиниба при ревматоидном артрите проходят 3 фазу. Основные результаты суммированы ниже (см. таблицу). Во 2 фазе исследований были проанализированы около 1000 пациентов, страдающих РА, и около 4000 больных – в 3 фазе [3].
Таблица. Данные терапевтического ответа при применении тофацитиниба длительностью до 12 недель (адаптировано по M. Gema Bonilla-Herna et al).
*р≤0,0001, **р≤0,05, ***р‹0,01, ****р‹0,0001, *****р‹0,05 (при сравнении групп приема тофацитиниба с группой плацебо). МТК – метотрексат; ТФ – тофацитиниб; НД – нет данных; ACR 20,50 и 70 - критерии Американской коллегии ревматологов для определения 20%, 50% и 70% клинического улучшения; DAS-28 ремиссия – частота достижения индекса активности болезни (Disease activity score, DAS 28) менее 2,6 (DAS28<2,6)
| ACR20,% | ACR50,% | ACR70,% | DAS-28 ремиссия,% | |
|---|---|---|---|---|
| Фаза II: тофацитиниб+ МТК vs плацебо + МТК [5] | ||||
| Плацебо + МТК | 38 | 17 | 6 | 9 |
| ТФ 1мг 2р. в день+ МТК | 50 | 24 | 7 | 7 |
| ТФ 3мг 2р. в день+ МТК | 59** | 31 | 22** | 32** |
| ТФ 5мг 2р. в день+ МТК | 61** | 37** | 18** | 17 |
| ТФ 10мг 2р. в день+ МТК | 60** | 31 | 13 | 30** |
| ТФ 15мг 2р. в день+ МТК | 59** | 47** | 25** | 38** |
| ТФ 20мг 2р. в день+ МТК | 60** | 36** | 24** | 25** |
| Фаза II: монотерапия тофацитинибом, адалимумабом vs плацебо [6] | ||||
| плацебо | 29 | 12 | 5 | 7 |
| ТФ 1мг 2р. в день | 35 | 15 | 7 | 9 |
| ТФ 3мг 2р. в день | 49***** | 25 | 12 | 9 |
| ТФ 5мг 2р. в день | 63*** | 41**** | 12 | 24***** |
| ТФ 10мг 2р. в день | 75*** | 49*** | 25**** | 34**** |
| ТФ 15мг 2р. в день | 75*** | 54*** | 28**** | 40*** |
| Алалимумаб 40мг каждую нед. | 47***** | 24 | 4 | 4 |
| Фаза III: монотерапия тофацитинибом vs плацебо [7] | ||||
| Плацебо | 27 | НД | НД | 4 |
| ТФ 5мг 2р. в день | 60* | НД | НД | 6 |
| ТФ 10мг 2р. в день | 66* | НД | НД | 10 |
Последние данные, опубликованные Gerd Burmester и коллегами [8], свидетельствуют о значимом клиническом улучшении при применении сочетанной терапии тофацитинибом и метотрексатом в популяции пациентов с ревматоидным артритом, рефрактерных к лечению ингибиторами ФНО-альфа. Так, после 3 месяцев терапии частота достижения ответа ACR20 составила 41,7% (55 из 132; p=0,0024) при приеме тофацитиниба 5мг 2р. в день и 48,1% (64 из 133; p<0,0001) при приеме тофацитиниба 10мг 2р. в день по сравнению с 24,4% (32 из 131) при приеме плацебо. Подобно этим результатам, тофацитиниб показал свою эффективность при монотерапии и в сравнении тофацитиниба с адалимумабом vs плацебо.
На основании этого, FDA в декабре 2012г. утвердило тофацитиниб в дозе 5мг дважды в день для лечения взрослых лиц, страдающих ревматоидным артритом, средней и тяжелой степени активности с неадекватным ответом на терапию метотрексатом[9]. Следует также отметить, что производственная стоимость ингибиторов янус-киназ намного ниже соответствующих биоагентов, применяемых в лечении РА [3].
Несмотря на клиническую эффективность и хороший фармакоэкономический прогноз препарата, существенный интерес представляют данные о безопасности, которые необходимы нам для оценки соотношения риска и пользы. Большинство нежелательных реакций объясняется тем, что ингибиторы янус-киназ являются, по сути, неселективными ингибиторами цитокинов [3]. В ряду побочных эффектов выделяют несколько групп: активация различных инфекционных процессов, в частности возможность реактивации туберкулеза; нарушение липидного обмена и связанный с ним риск сердечно-сосудистых заболеваний; риск острой печеночной недостаточности [1].
Перспективой в улучшении профиля безопасности может служить использование биомаркеров для выявления лиц, генетически предрасположенных к развитию тяжелых побочных реакций [10].
Следующим этапом в изучении влияния «малых молекул» на течение рассматриваемой патологии, по-видимому, станет демонстрация влияния на деструкцию кости и хряща, и в целом на восстановление сустава. Также необходимо проведение долгосрочных исследований по оценке риска развития раковых и сердечно-сосудистых заболеваний.
Резюмируя, можно сказать, что ингибиторы сигнальных молекул могут стать следующим краеугольным камнем в терапии ревматоидного артрита. Фундаментальное понимание полученных знаний о группе этих препаратов позволяет исследовать их в лечении и других заболеваний: псориаза, неспецифического язвенного колита (НЯК), состояния после трансплантации.
Литература.
- Pierre Miossec. Kinase inhibition in rheumatoid arthritis: a big advance? The Lancet, Volume 381, Issue 9865 Published Online January 5, 2013 http://dx.doi.org/10.1016/S0140-6736(12)61722-X
- Giles J, Bathon JM. Management of rheumatoid arthritis: synovitis. Rheumatology 2010;1:95563.
- M. Gema Bonilla-Herna et al. New drugs beyond biologics in rheumatoid arthritis: the kinase inhibitors. Rheumatology 2011;50:1542-1550 http://dx.doi.org/doi:10.1093/rheumatology/ker192
- Changelian PS, Flanagan ME, Ball DJ, et al. Prevention of organ allograft rejection by a specifi c Janus kinase 3 inhibitor. Science 2003; 302: 875–78.
- Kremer J et al. The oral Jak Inhibitor CP-690,550 (CP) in combination with methotrexate (MTX) is efficacious, safe and well tolerated in patients with active rheumatoid arthritis (RA) with an inadequate response to methotrexate alone. In: 2008 Congress American College of Rheumatology. Abstract L13
- Fleischmann R, Kremer J, Cush J, et al. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med 2012; 367: 495–507.
- van Vollenhoven RF, Fleischmann R, Cohen S, et al. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med 2012; 367: 508–19.
- Prof Gerd R Burmester MD et al. Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. The Lancet, Volume 381, Issue 9865, Pages 451 - 460, 9 February 2013 http://www.clinicaltrials.gov/, number NCT00960440.
- Food and Drug Administration. FDA approves Xeljanz for rheumatoid arthritis. Nov 6, 2012. http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm327152.htm (accessed Dec 17, 2012).
- Miossec P, Verweij CL, Klareskog L, et al. Biomarkers and personalized medicine in rheumatoid arthritis: a proposal for interactions between academia, industry and regulatory bodies. Ann Rheum Dis 2011; 70: 1713–18.