Проблема микробных биопленок становится все более актуальной в последние десять лет. И если еще в 1990-е годы были единичные публикации по этому вопросу, то на сегодняшний день не только накоплены значительные теоретические знания в этой области, но и существует ряд практических исследований. Хотелось бы представить данные, которые мы получили в лабораториях двух больших клинических баз - Научного Центра сердечно-сосудистой хирургии имени А.Н. Бакулева РАМН, где мне посчастливилось в течение восьми лет возглавлять лабораторию клинической микробиологии и антимикробной терапии, и детской клиническая больницы имени Н. Ф. Филатова, где сейчас мы организуем лабораторию сепсиса. В настоящей лекции мне бы хотелось не только обсудить факты, опубликованные нашими зарубежными коллегами, но и представить вам некоторые результаты собственных исследований.
С чем связана актуальность этой проблемы? Самые разные области медицины занимаются микробными биопленками, но сегодня мы коснемся в первую очередь, проблемных инфекций в стационаре, внутрибольничных инфекций, пневмонии, сепсиса. Вызваны они, так называемыми, проблемными микроорганизмами, клебсиеллой и кишечной палочкой, продуцирующими беталактамазы расширенного спектра (ESBL). На сегодняшний день они приобрели устойчивость абсолютно ко всем препаратам, за исключением некоторых карбапенемов. Следует также отметить Pseudomonas aeruginosa, Acinetobacter baumanii, Stenotrophomonas maltophilia – микроорганизмы, отвественные за инфекционные осложнения у пациентов отделений реанимации и интенсивной терапии. Среди грамположительных бактерий следует отметить стафилококки, как метициллинрезистентный золотистый стафилококк (MRSA), так и метициллинрезистентный эпидермальный стафилококк (MRSE), энтерококк, не только faecalis, но и faecium, целый ряд грибковых возбудителей. Появившийся в медицине сравнительно недавно термин «multi drug resistant», объединяет основные проблемы лечения инфекций, вызванных этими возбудителями. С чем же это связано? Оказывается, сегодня мы не можем решить многие проблемы госпитальных инфекций, сепсисов, пневмоний, и так далее, именно потому, что мы еще очень мало знаем и очень мало умеем в области управления микробными биопленками. В процессе формирования микробной биопленки условно можно выделить три стадии – микроб прикрепляется либо к естественной поверхности, либо к какому-то синтетическому материалу, и затем он формирует микробную биопленку, продуцируя экстрацеллулярный матрикс, то есть он становится защищенным от воздействия антимикробных препаратов и иммунных факторов защиты – нейтрофилов, интерлейкинов, иммуноглобулинов. И только в тех ситуациях, когда это нужно микроорганизмам, они покидают эту микробную биопленку, циркулируют во внутренней среде организма, и тогда мы можем обнаружить эти микроорганизмы в крови и других биологических жидкостях и тканях. Самое интересное, что микроорганизмы, заключенные в эту биопленку, гликокаликс, обладают совершенно другими свойствами. У них и другие свойства в плане антибиотикорезистентности, у них другие свойства метаболические, и они могут серьезно влиять и на метаболические процессы в организме человека, в организме хозяина, в котором они живут. В классической микробиологии, как известно, в основном этапы исследования представляют собой выделение обязательно чистой культуры, идентификацию, исследования чувствительности, но все это касается исследования бактерий, как одноклеточных форм, так повелось издавна еще со времен Коха и Пастера. То есть все наши знания о свойствах бактерий, их чувствительности к антибиотикам были получены при изучении чистых культур микроорганизмов. На самом деле, как показали последние исследования, в природе чистые культуры, в так называемой планктонной форме, то есть в виде циркуляции отдельных клеточных элементов, практически отсутствуют. И в водоемах, и на поверхности почвы, и в самых разных других областях, а тем более, в организме человека, микробы существуют в виде биопленок. На протяжении каких-то 50-ти лет активного производства и использования антимикробных препаратов человечеством были побеждены многие опасные инфекции - сегодня ни чума, ни сибирская язва, ни холера, ни дифтерия уже не вызывают эпидемий. А вот такие заболевания, как сепсис, в отделениях интенсивной терапии стали действительно серьезной проблемой. По данным многих международных исследований, сегодня сепсис и связанная с ним полиорганная недостаточность, стали основной причиной летальных исходов в отделениях интенсивной терапии всех цивилизованных стран мира. Скорее всего, это связано с тем, что наши знания клинической микробиологии и наши методы управления микробами в организме больного человека, до сих пор все еще строятся по принципу работы с одноклеточными культурами. Не менее 65% госпитальных инфекций связано именно с биопленками, и все это обходится системам здравоохранения различных стран в миллиарды долларов [1] Доказано, что на таких, широко применяемых в современной медицине, инструментах, как катетеры, имплантанты, приспособления из полимерных материалов, зонды, стенты, интубационные трубки, контактные линзы и т.п. практически всегда формируются микробные биопленки. В развитии и прогрессировании таких заболеваний как муковисцидоз, эндокардит, отиты, периодонтиты, простатиты, остеомиелит, хронический риносинусит, трофические язвы, пролежни, язвы диабетических стоп абсолютно доказано участие и большая патогенетическая роль именно микробной биопленки. Более того, для очень многих микроорганизмов, таких как стафилококк, энтерококк, клебсиелла, синегнойная палочка, и т.д. доказана способность формировать биопленки. Таким образом, хотелось бы сказать, что со временем, и я думаю, что это произойдет в ближайшие годы, мишенью для воздействия на инфекционный и микробный процесс, станут не только сами бактерии, но и биопленки. Если бы нам удалось препятствовать формированию гликокаликса, в который заключены микробы, наверное, достижение цели элиминации бактерий было бы намного более реальным.
Существуют ли какие-то способы воздействия на процесс формирования биопленок, или способы разрушения уже существующих биопленок? Естественно, за короткий срок лекции мы не сможем охватить сотни тысяч публикаций, но я покажу вам несколько коротеньких выдержек из них. Начиная с конца 1990-х годов в литературе стали появляться работы, изучающие возможность некоторых препаратов, например, кларитромицина, ингибировать образование гликокаликса, который продуцируется в данном случае метициллинрезистентным золотистым стафилококком [2]. Авторы другой работы приводили данные сравнительных исследований, доказывающие способность кларитромицина в комбинации с цефалоспорином I поколения или ванкомицином препятствовать образованию биопленок на титановом медицинском оборудовании [3]. Для синегнойной палочки также выявлена способность к формированию биопленки. При детальном изучении механизма воздействия препарата кларитромицин на образование биопленки, было показано, что структура биопленки изменяется, уменьшается количество альгината, гексозы, истончается гликокаликс, тем самым повышается проникновение антимикробного препарата, который использовали для подавления синегнойной палочки, в данном случае – фторхинолон. Эффективность фторхинолона оказалась значительно выше в присутствии кларитромицина, что привело к эрадикации синегнойной палочки [4]. Интересны также клинические исследования на больных с муковисцидозом и диффузным панбронхиолитом, в ходе которых было показано совместное использование для воздействия на синегнойную палочку кларитромицина с этиотропными антибиотиками [5].
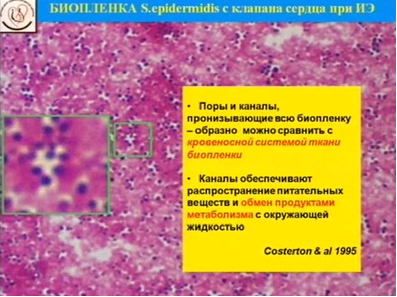
На рисунке представлен микропрепарат, полученный нами при специальной окраске биопленки, образованной эпидермальным стафилококком, штамм выделен из клапана больного с инфекционным эндокардитом. Как видно на рисунке (увеличенный фрагмент) биопленка представляет собой не только микроорганизмы, стафилококки, но и поры, каналы, которые пронизывают эту биопленку, эти каналы обеспечивают как распространение питательных веществ внутрь биопленки для питания бактерий, так и выделение продуктов метаболизма в окружающую среду, напоминая, таким образом систему кровеносных сосудов [6].
Рисунок 1. Биопленка S.epidermidis с клапана сердца при инфекционном эндокардите
Проблема инфекции, вызванной синегнойной палочкой, чрезвычайно актуальна, и, по-видимому, она так долго оставалась нерешенной именно потому, что вопросы воздействия на биопленку ранее не были известны. Нами было проведено исследование, доказывающее способность препарата клацид (кларитромицин) препятствовать образованию биопленки. Это исследование мы провели ин-витро. Синегнойная палочка выращивалась как планктонная форма, в пробирке, и, как биопленка – на пластиковой чашке Петри. Соответственно, через 2, 4, 6 или 8 часов от момента посева микроорганизма в питательную среду, мы добавляли антибактериальные препараты. В контрольной чашке, где была засеяна синегнойная палочка, и сразу был добавлен карбапенем (имипенем), биопленка не образовалась. Действительно, чувствительность штамма к имипенему была установлена заранее, и препарат сработал так, как и ожидалось. Но если мы добавляли имипенем позднее, то есть дали возможность микроорганизму просуществовать в питательной среде какое-то время, то мы обнаружили, что биопленка все равно потом образовалась, то есть добавление имипенема не смогло препятствовать образованию биопленки, образованной синегнойной палочкой. То есть даже карбапенем, активный в отношении синегнойной палочки (имипенем), не сумел препятствовать формированию биопленки. Мы попробовали провести тот же эксперимент с одним кларитромицином в форме монотерапии. После добавления кларитромицина, чашка не была прозрачной, то есть микроорганизмы в этой чашке продолжали размножаться. Но вот когда мы добавили одновременно этиотропный препарат имипенем (карбапенем) и кларитромицин, в результате получили абсолютно прозрачную чашку, то есть биопленка в этой ситуации не образуется. Каждый из этих экспериментов был повторен многократно, для того, чтобы убедиться в действительно объективной картине. В таблице 1 обобщены полученные нами данные. В контроле, независимо от времени добавления антибиотиков, во всех случаях, естественно, был рост и в планктонной форме, и в виде биопленки. Но одновременное использование имипенема вместе с клацидом, препятствовало формированию биопленки.
Таблица 1. Результаты, полученные при исследовании влияния кларитромицина и имипенема, а также их комбинации на формирование биопленок
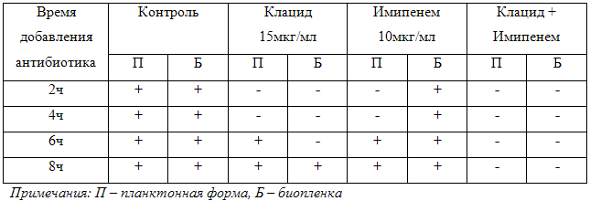
Таким образом, наши экспериментальные данные полностью подтвердили зарубежные. Даже «мощный» карбапенем, эффективен только в пределах 4 часов после развития синегнойной инфекции, вызванной планктонными формами и неэффективен если образуется биопленка. Кларитромицин разрушает биопленку P. аeruginosa независимо от времени введения, существенно повышая активность антисинегнойного антибиотика. Несмотря на то, что кларитромицин не смог препятствовать росту синегнойной палочки, поскольку синегнойная палочка не входит в его антимикробный спектр, одновременное использование кларитромицина и карбапенема препятствовало размножению синегнойной палочки и образованию биопленки в нашем эксперименте. Таким образом, для повышения эффективности лечения нужно проводить «анти-биопленочную» терапию: этиотропные препараты комбинировать с кларитромицином.
Еще один очень важный аспект – то, что микробные биопленки во много раз снижают эффективность антибиотиков, то есть повышают устойчивость бактерий к антибиотикам по некоторым данным, в 100-1000 раз [7]. В то же время, исследования целого ряда авторов показали, что кларитромицин не только разрушает матрикс биопленок, образованных P. аeruginosa, но и снижает ее двигательную активность, что приводит к снижению вирулентности и существенному повышению эффективности специфических антисинегнойных препаратов [8]. Кроме того, кларитромицин разрушает матрикс биопленки, облегчая доступ другим антибиотикам [9].
И в заключение мне хотелось бы представить результаты еще одного, на мой взгляд, самого интересного исследования. Это исследование клиническое, дизайн исследования - многоцентровое, проспективное, рандомизированное, плацебо-контролируемое, оно было проведено в отделениях интенсивной терапии 5 крупных медицинских центров западноевропейских стран. В исследование было включено 200 пациентов с ИВЛ-ассоциированной пневмонией и нозокомиальным грамотрицательным сепсисом [10]. Согласно протоколу, все пациенты были рандомизированы на две группы, одна из которых получала обычную этиотропную терапию и плацебо, а другая – комбинацию этиотропных препаратов с кларитромицином, последний в дозе 1 гр в сутки вводили в течение трех дней, внутривенно. Микроорганизмы, которые были идентифицированы у этих пациентов – это ацинетобактер, синегнойная палочка, клебсиелла. Результаты исследования показали, что в группе, где, кроме обычной этиотропной антимикробной терапии, добавлялся еще и кларитромицин, время разрешения пневмонии было значительно короче, срок экстубации был короче, и, что очень важно - время до развития полиорганной недостаточности, если она развивалась, оказалась значительно большим (см. табл. 2). Следует еще раз отметить, что по протоколу исследования пациенты получали кларитромицин всего три дня. Возможно, если бы эта схема представляла собой более длительный прием, полиорганная недостаточность была бы не только отдалена по времени, но и не развилась бы совсем. Можно приводить много публикаций, доказывающих клиническую эффективность совместного применения этиотропных антибиотиков с кларитромицином у пациентов с сепсисом, вентилятор-ассоциированной пневмонией, инфекцией мочевыводящих путей, вызванной кишечной палочкой, синегнойной палочкой. Более того, на международном конгрессе в Брюсселе (29th ISICEM, 26 марта 2009 года) даже был представлен доклад с интригующим названием – «Claritromycin for all?»
Таблица 2. Сравнительная эффективность кларитромицина и плацебо в комбинации с этиотропными антибактериальными препаратами у пациентов с ИВЛ-ассоциированной пневмонией и нозокомиальным сепсисом по [10]
![Сравнительная эффективность кларитромицина и плацебо в комбинации с этиотропными антибактериальными препаратами у пациентов с ИВЛ-ассоциированной пневмонией и нозокомиальным сепсисом по [10]](/files/articles/cardiology/beloborodova_03.png)
Какое резюме хотелось бы сделать после изложенных выше данных? Разумеется, у тяжелых больных, у больных в отделениях интенсивной терапии, у больных с хроническими заболеваниями, до сих пор роль микробных биопленок, недооценивается, и на сегодняшний день имеются достаточно обнадеживающие данные о том, что комбинированная терапия этиотропным антибиотиком, вместе с кларитромицином, действительно целесообразна. Благодарю вас за внимание.
Список литературы:
1. Olson ME et al. Biofilm bacteria: formation and compararive susceptibility of antibiotics. Can J Vet Res 2002 April; 66(2): 86-92.
2. Sano M, Hirose T, Nishimura M et al. Inhibitory action of clarithromycin on glycocalyx produced by MRSA. J Infect Chemother 1998; 5:10-5.
3. Fujimura S, Sato T, Mikami T et al. Combined efficacy of clarithromycin plus cefazolin or vancomycin against Staphylococcus aureus biofilms formed on titanium medical devices. Inter J Antimicrob Agent 2008; 32(6):481-4.
4. Yasuda H, Ajiki Y, Koga T et al. Interaction between biofilms formed by Pseudomonas aeruginosa and clarithromycin. Antimicrob Agents Chemother 1993; 37(9): 1749-1755.
5. Wozniak DJ, Keyser R. Effects of Subinhibitory Concentrations of Macrolide Antibiotics on Pseudomonas aeruginosa. Chest 2004; 125:625-695.
6. Costerton JW, Lewandowski Z, Caldwell DE, et al. Microbial Biofilms. Ann Rev Microbiol 1995; 49:711-45.
7. Ryder MA. Catheter-Related Infections: It's All About Biofilm. Topics in Advanced Practice Nursing eJournal. 2005;5(3); Olson ME et al. Biofilm bacteria: formation and compararive susceptibility of antibiotics. Can J Vet Res 2002 April; 66(2):86-92.
8. Wozniak DJ, Keyser R. Effects of Subinhibitory Concentrations of Macrolide Antibiotics on Pseudomonas aeruginosa. Chest 2004; 125:625-95.
9. Sano M, Hirose T, Nishimura M et al. Inhibitory action of clarithromycin on glycocalyx produced by MRSA. J Infect Chemother 1998; 5:10-15.
10. Giamarellos-Bourboulis EJ, Baziaka F, Antonopoulou A et al. Intravenous Clarithromycin in Septic Syndrome. Int J Antimicrob Agent 2008; 32S:39-43.