Цель обзора: освещение современных подходов к диагностике и лечению вазоренальной гипертензии
Последние данные литературы: Клиническое значение ВРГ обусловлено высокой распространенностью данного заболевания, а также его выраженным отрицательным влиянием на прогноз. К сожалению, выявлению ВРГ уделяется недостаточно внимания, хотя правильно собранный анамнез и тщательно проведенное физическое обследование вполне позволяют заподозрить наличие у пациента именно данной формы гипертензии. Клиническое обследование легко может быть дополнено безопасными неинвазивными методами диагностики, которые позволяют выявить поражение почечных артерий с высокой точностью. Гораздо сложнее ситуация с лечением данного заболевания. В настоящее время не существует исследований эффективности реваскуляризации почечных артерий, которые соответствовали бы критериям доказательной медицины.
Заключение: В связи отсутствием общепризнанных показаний к стентированию почечных артерий не существует, решение вопроса о необходимости выполнения реваскуляризации у каждого отдельного взятого пациента является прерогативой лечащего врача.
Вазоренальная гипертензия (ВРГ), на сегодняшний день, – наиболее распространенная форма вторичной, или симптоматической, гипертензии и обнаруживается у 5% пациентов с повышенным артериальным давлением [1]. Подавляющее большинство поражений почечных артерий, приводящих к развитию ВРГ, обусловлено атеросклеротическим процессом, а также фиброзно-мышечной дисплазией и неспецифическим аортоартериитом [2]. Согласно крупномасштабным скрининговым исследованиям, распространенность гемодинамически значимых (60% и более) стенозов почечных артерий (СПА) среди пациентов старше 60 лет составляет 6,8% [3], в то же время, по данным аутопсий – уже 27% [4]. Как правило, в клинической практике поражение почечных артерий развивается в рамках мультифокального атеросклероза: оно выявляется у 18-20% пациентов с ИБС при ангиографическом исследовании [5] и у 35-50% пациентов с ишемией нижних конечностей [6]. В последнее время многие авторы подчеркивают необходимость четко разграничивать понятия «атеросклеротическое поражение почечных артерий» и «вазоренальная гипертензия» как стойкого, резистентного к лечению повышения артериального давления, вызванного снижением перфузии почечной ткани [7,8], ввиду того, что СПА, в особенности гемодинамически незначимые, далеко не всегда вызывают клиническую симптоматику.
СПА могут иметь самые разные клинические проявления от бессимптомных, случайных находок до угрожающих жизни состояний (рис. 1).
Рисунок 1. Клинические проявления стеноза почечных артерий [по Braunwald’s Heart Disease, 2008, p 1039]
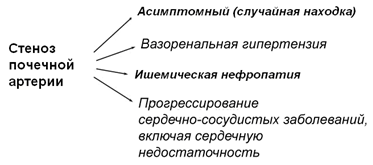
Естественное течение атеросклеротического процесса в почечных артериях активно изучается уже более 30 лет, при этом результаты остаются достаточно противоречивыми. По разным данным, прогрессирование поражения (увеличение степени стеноза по результатам ангиографического исследования) имеет место у 39-60% пациентов [9].
Согласно современному исследованию Caps [10], в котором для оценки степени СПА у пожилых пациентов (средний возраст – 68 лет) использовалось дуплексное сканирование почечных артерий, частота прогрессирования атеросклеротического поражения составила 35% в течение 3 лет и 51% в течение 5 лет. Риск развития гемодинамически значимого (>60%) стеноза зависел, прежде всего, от исходного состояния почечных артерий: при отсутствии атеросклеротического поражения в начале исследования он составил 33%, при наличии незначимого стеноза – 75% за 5 лет. Другими факторами риска в отношении прогрессирования сужения артерий выступили систолическое артериальное давление >160 мм рт. ст. и сахарный диабет II типа. Интересно, что частота развития окклюзий почечных артерий была невысока и составила всего 3%, причем все окклюзии сформировались на фоне исходных СПА >60%. Сравнимые данные получены в исследовании Schreiber и Tollefson [11,12].
Прогрессирование атеросклеротического процесса в почечных артериях приводит к постепенной атрофии почек. В исследовании Guzman [13] размеры почек у больных со СПА >60% изучались в течение 2 лет. Уменьшение длины почек как минимум на 1.5 см было выявлено у 26% пациентов. Такое снижение размеров почки неминуемо приводит к ухудшению ее функции, хотя в этом процессе важную роль играют и другие факторы, такие как длительное повышение артериального давления у пациентов с ВРГ. В работе Connoly и соавторов [14] изучалась функция почек у пациентов с гемодинамически значимыми СПА. За 2 года зависимыми от гемодиализа стали 3% больных с унилатеральным СПА, 18% с билатеральным СПА и 55% со СПА единственной функционирующей почки. В целом, в США ежегодно 14-16% всех случаев перевода на гемодиализ связаны с атеросклеротическими СПА [15,16].
Следует указать, что, помимо атеросклеротического поражения, у взрослых нередко наблюдается фибропластическое поражение почечных артерий. Атеросклероз, как правило, поражает проксимальную треть почечной артерии, чаще страдают пожилые мужчины. Фибропластические изменения обычно захватывают дистальные две трети почечных артерий или их основные ветви и чаще встречаются у молодых женщин. Другими причинами реноваскулярной гипертензии могут служить холестериновые эмболы или обструкция почечных артерий опухолями.
Патофизиология ВРГ.
Теоретические основы патогенеза вазоренальной гипертензии были заложены в классических исследованиях Goldblatt [17] в 30-х годах прошлого века, когда впервые было доказано, что снижение перфузии почек приводит к повышению артериального давления. Последующие работы установили ключевую роль в этом процессе ренин-ангиотензин-альдостероновой системы [18,19].
Первоначальная реакция почки на снижение ее перфузии состоит в активации юкстагломерулярного аппарата, что приводит к повышению секреции ренина. Ренин катализирует превращение ангиотензиногена в ангиотензин 1 (АТ1). В легких АТ1 под воздействием ангиотензинпревращающего фермента (АПФ) трансформируется в ангиотензин 2 (АТ2). АТ2 является мощным вазоконстриктором, а также стимулирует секрецию альдостерона.
Дальнейшие исследования позволили выявить некоторые нюансы данной проблемы, в том числе принципиальные отличия в патогенезе вазоренальной гипертензии с односторонними и двусторонними стенозами почечных артерий (т.н. 2-kidney-1-clip и 1-kidney-1-clip модели вазоренальной гипертензии).
При одностороннем стенозе почечных артерий (модель 2-kidney-1-clip) увеличение секреции ренина ишемизированной почкой вызывает активацию ренин-ангиотензин-альдостероновой системы и повышение системного артериального давления. Это приводит к тому, что «здоровая» почка на фоне увеличения перфузии и воздействия натрийуретиков экскретирует повышенное количество жидкости и электролитов, что вызывает снижение системного артериального давления и дальнейшее уменьшение перфузии почки со стенозом, замыкая тем самым порочный круг. Таким образом, ведущую роль в патогенезе вазоренальной гипертензии при одностороннем стенозе почечной артерии играет повышенная активность ангиотензина II и ренина плазмы.
При двустороннем стенозе почечных артерий отсутствует возможность повышения экскреции жидкости и электролитов в ответ на стимуляцию вазопрессорами. В связи с этим в основе патогенеза вазоренальной гипертензии при модели 1-kidney-1-clip лежит объемная перегрузка, вызванная избыточной задержкой воды и натрия в организме [20].
В ходе недавних исследований были обнаружены дополнительные механизмы развития вазоренальной гипертензии, такие как оксидативный стресс, эндотелиальная дисфункция, повышение активности симпатической нервной системы, однако уточнение их роли в патогенезе вазоренальной гипертензии требует дополнительного изучения [21-23].
Эти факты свидетельствуют о том, что наличие СПА приводит к серьезным изменениям в нейрогуморальной системе организма и опасно не только для функции почек (рисунок 2). Неконтролируемая в течение длительного времени артериальная гипертензия может привести к быстрому развитию таких осложнений как гипертрофия левого желудочка, хроническая сердечная недостаточность, инсульт и ретинопатия. Все описанные особенности патогенеза необходимо учитывать при выборе тактики лечения пациентов с ВРГ.
Рисунок. 2 Механизм развития ВРГ и её осложнений. РААС – ренин-ангиотенизиновая система; СНС – симпатическая нервная система. По Dubel G. J. and Murphy T.P. «The role of percutaneous revascularization for renal artery stenosis», Vascular Medicine, 2008; 13; 141]
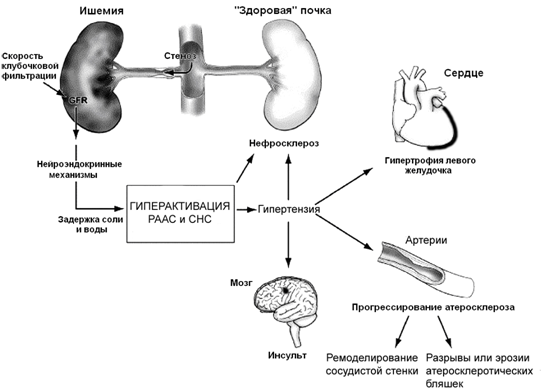
Диагностика ВРГ.
Хотя специфических симптомов, указывающих на наличие ВРГ, не существует, некоторые особенности клинического течения артериальной гипертонии заставляют задуматься об ее связи со СПА.
Ключи к клиническому диагнозу вазоренальной АГ перечислены в таблице 1. Показания к выполнению инструментального обследования для изучения почечного кровотока и возможной реваскуляризации при обнаружении СПА по рекомендациям American Heart Association изложены в таблице 2.

Атеросклеротические бляшки, как правило, формируются на обеих почечных артериях, значительно преобладая на одной из сторон. Двусторонние стенозы можно заподозрить в случае быстропрогрессирующей олигурии и почечной недостаточности без признаков обструкции мочевыводящих путей, особенно в случае дебюта после назначения ингибиторов АПФ или блокаторов АТ1-рецепторов.
Наиболее распространенными методами исследования почечного кровотока являются дуплексное сканирование, КТ- и МР-ангиография. Особое место в диагностике СПА занимает «классическая» ангиография по Сельдингеру, т.к. она не только остается «золотым стандартом» диагностики данной патологии, но и может, при необходимости, трансформироваться в лечебную процедуру – ангиопластику или стентирование почечной артерии. Такие методы как определение уровня ренина в периферической крови и в почечных венах, а также сцинтиграфия почек в настоящее время используются все реже в связи с их низкой чувствительностью и специфичностью [25].
Дуплексное ультразвуковое сканирование почечных артерий позволяет не только визуализировать просвет почечной артерии и ее ветвей, но и получить информацию о гемодинамике, измерить линейную скорость кровотока в различных участках артериального русла, оценить перфузию различных областей почек. Несмотря на возможные технические проблемы в ходе исследования (выраженное ожирение пациента, наличие газа в кишечнике, аномалии расположения почек), при качественной визуализации, которой можно добиться лишь у 40 – 60 % пациентов, дуплексное сканирование демонстрирует впечатляющие результаты в выявлении СПА: этот метод обладает чувствительностью в 97% и специфичностью в 98% [26].
КТ- и МР-ангиография также зарекомендовали себя с лучшей стороны для скрининга ВРГ: оба метода обладают чувствительностью и специфичностью более 90% [27,28]. К преимуществам МР-ангиографии можно отнести меньшее количество артефактов от включения кальция, отсутствие необходимости во введении йодсодержащего контрастного вещества и лучевой нагрузки. КТ-ангиография, в свою очередь, предпочтительна для выявления добавочных почечных артерий.
Алгоритм диагностики и лечения ВРГ представлен на рисунке 3.
Рисунок 3. Алгоритм диагностики и лечения По Dubel G. J. and Murphy T.P. «The role of percutaneous revascularization for renal artery stenosis», Vascular Medicine, 2008; 13; 141]
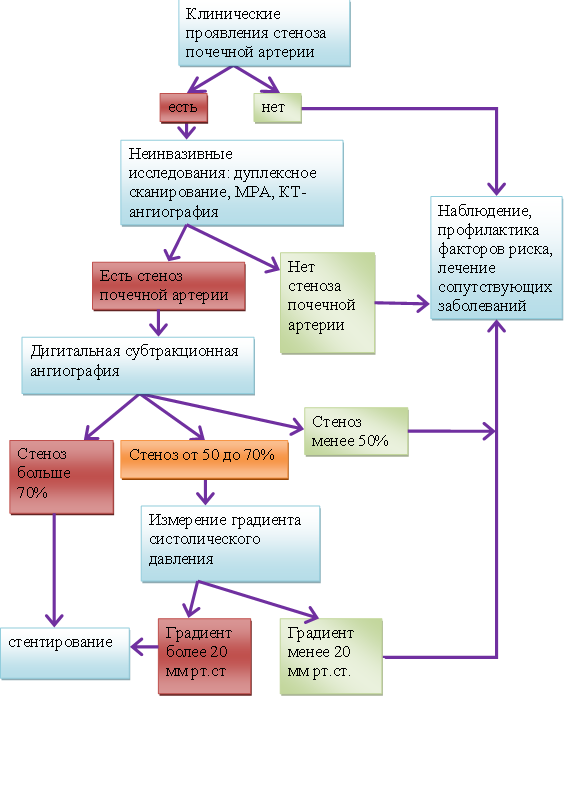
Основной целью лечения пациентов с ВРГ является поддержание артериального давления на классических цифрах <140 и 90 мм рт.ст. при отсутствии сопутствующей патологии и <130 и 80 мм рт.ст. у пациентов высокого риска, в том числе с сахарным диабетом II типа, хроническими заболеваниями почек и перенесших инсульт [29]. Не вызывает сомнений, что тщательный контроль АД на данных цифрах позволяет добиться существенного снижения темпов прогрессирования поражения органов-«мишеней» АГ.
Применение ингибиторов АПФ и блокаторов АТ1-рецепторов в случае ВРГ подобно обоюдоострому мечу: с одной стороны, они наиболее эффективны в отношении снижения АД, а с другой их применение может привести к еще большему снижению кровоснабжения изначально ишемизированной почки, посредством снижения уровня ангиотензина II. Блокирование ренин-ангиотензиновой системы может быть фатальным при наличии критического стеноза единственной почки, а в ряде случаев и при наличии тяжелого двустороннего поражения почечных артерий во избежание падения АД. Описаны случаи резкого ухудшения функции почек в связи с их ишемией при назначении данных препаратов, хотя в большинстве своем данные нарушения обратимы [32]. Следует учитывать, сочетание ингибитора АПФ и блокатора АТ1-рецепторов может быть опасным ввиду того, что может дополнительно ухудшить функцию почек, как показало исследование VALIANT.
Особенно сложным представляется ведение неоперабельных больных с тяжелой резистентной АГ. Одной из стратегий может быть назначение малых доз ингибиторов АПФ или блокаторов ангиотензиновых рецепторов совместно с блокаторами кальциевых каналов – сочетания, приводящего к расширению как отводящей, так и отводящей почечных артериол. Такое лечение следует проводить под тщательным контролем уровня креатинина и К+ плазмы крови, а также суточного диуреза. В дальнейшем возможно аккуратное титрование дозы ингибитора АПФ. Важно подчеркнуть, что зачастую на практике наблюдается не истинная «резистентная» АГ, а псевдорезистентная, связанная с перегрузкой объемом, когда даже сочетание блокаторов кальциевых каналов, бета-блокаторов и ингибиторов АПФ неэффективно без адекватной диуретической терапии.
В ряде случаев, при незначительно повышенном креатинине, эффект может дать назначение дипиридамола в малых-средних дозировках 2 – 3 раза в день.
Важной частью лечения пациентов с ВРГ является проведение антиагрегантной и гиполипидемической терапии, тщательный контроль уровня гликемии и уровня гликозилированного гемоглобина – у пациентов с сахарным диабетом. Все эти меры позволяют снизить частоту сердечно-сосудистых осложнений у данной группы пациентов [33,34].
В лечении ВРГ важны и немедикаментозные меры: снижение потребления соли вплоть до употребления в пищу пресной пищи, прекращение курения, снижение массы тела, контроль уровня эмоционального стресса.
Хотя польза медикаментозного лечения не вызывает сомнений, побочные эффекты высокодозовой терапии зачастую плохо переносятся этой категорией пациентов, не у всех больных возможно добиться адекватно контроля АД даже при применении максимальных доз четырех-пяти препаратов различных классов, параллельно снижается приверженность к лечению [35]. Согласно некоторым исследованиям, только 50% пациентов с АГ следуют указаниям врачей и соблюдают рекомендации по приему лекарственных препаратов, а целевых цифр АД удается достичь всего лишь у 33% больных [36]. В связи с этим, важную роль в лечении ВРГ играет реваскуляризация почечных артерий. которая может быть полезна даже в том случае, если не вызывает снижение АД до целевых цифр, а только приводит к снижению количества антигипертензивных препаратов, получаемых пациентом, или их дозировки, так как позволяет повысить приверженность к лечению и добиться лучшего контроля АД.
Интервенционные методы лечения ВРГ.
Развитие новых медицинских технологий существенно расширило возможности оперативного лечения вазоренальной гипертензии. Рентгенхирургические методы лечения (ангиопластика, стентирование) стали альтернативой открытым операциям по шунтированию почечных артерий, которые сопряжены с большой травматичностью. Впервые ангиопластику почечных артерий выполнил Gruntzig в 1978 году [37, 38]. Его работы продемонстрировали высокую частоту технического успеха и относительную безопасность ангиопластики почечных артерий, однако не самые лучшие, по сравнению с открытыми операциями, отдаленные результаты данной процедуры (особенно при наличии устьевого поражения) заставили исследователей совершенствовать методику интервенционных вмешательств. Результатом этих усилий стало широкое внедрение в клиническую практику чрескожной имплантации эндопротезов (стентов) в почечные артерии (впервые данная процедура была описана Palmaz в 1987 году [39]).
С этого времени инструментарий для интервенционных вмешательств на почечных артериях непрерывно совершенствовался, что в совокупности с бурным развитием методов диагностики почечного кровотока, таких как дуплексное сканирование, КТ- и МР-ангиография, привело к стремительному росту популярности хирургического подхода к ведению пациентов с вазоренальной гипертензией у кардиологов по всему миру. Только за период с 1996 до 2000 год общее количество реконструктивных операций на почечных артериях выросло на 62%. При этом доля открытых операций уменьшилась на половину, а доля рентгенхирургических процедур, наоборот, возросла более чем в 2 раза [40]. В настоящее время главную роль в реваскуляризации почек играют именно методы интервенционной радиологии.
По мере активного внедрения в клиническую практику стентирования как метода улучшения результатов интервенционного лечения стенозов различной локализации обострялась дискуссия о целесообразности имплантации стентов при рентгенохирургическом лечении ВРГ. В исследовании Baumgartner и соавторов [41] изучалась эффективность стентирования по сравнению с баллонной ангиопластикой почечных артерий в зависимости от локализации стеноза. Поражения классифицировались как устьевые (локализованные на расстоянии не более 5 мм от аорты) и неустьевые (расположенные далее 5 мм от аорты). Было выявлено статистически достоверное преимущество стентирования при лечении устьевых стенозов: в течение года после вмешательства оставались проходимыми (рестеноз не более 60% по данным ДС или ангиографии) 80% сосудов после стентирования и только 34% сосудов после ангиопластики (р< 0.05, снижение риска рестеноза на 70%). В то же время, имплантация стентов, также как и открытые операции, не приводила к существенному улучшению отдаленных результатов при лечении неустьевых стенозов (проходимость через год 71% после стентирования и 65% после баллонной ангиопластики, р>0.05). Сходные результаты были получены в исследовании van de Ven и соавторов [42]. Учитывая высокую распространенность именно устьевого поражения почечных артерий атеросклеротическим процессом, эти данные имеют большое значение для подбора оптимальной тактики вмешательства при ВРГ. В настоящее время можно считать доказанным, что стентирование является методом выбора при наличии устьевого поражения почечных артерий.
До настоящего момента остается неясным, позволяет ли реваскуляризация почечных артерий, по сравнению с консервативной терапией, уменьшить смертность пациентов от сердечно-сосудистых заболеваний, добиться хорошего контроля уровня артериального давления, улучшить или хотя бы стабилизировать функцию почек. В связи с этим влияние рентгенохирургических методов лечения СПА на функции почек и уровень артериального давления до сих пор остается предметом обсуждения.
Результаты ранних исследований свидетельствовали об улучшении функции почек после реваскуляризации только у пациентов с двусторонними стенозами почечных артерий или на ранних стадиях почечной недостаточности [43]. В то же время, при наличии у больных односторонних стенозов, сахарного диабета или нефросклероза эффективность рентгенохирургических вмешательств на почечных артериях ставилась под сомнение [44].
Bates и соавторы изучали изменения функции почек после стентирования почечных артерий [45]. В это исследование вошли 194 пациента с впервые выявленными СПА. Нуждающимися в коррекции считались стенозы от 70% и более. Показаниями к стентированию были резистентная к лечению как минимум двумя препаратами артериальная гипертензия, азотемия, почечная и сердечная недостаточности, отек легких, обусловленный левожелудочковой недостаточностью. Концентрация креатинина в крови определялась в течение месяца до процедуры (минимальный срок, достаточный для включения в исследование) и в течение 6 месяцев после нее. Содержание креатинина в крови более 1.5 мг/дл считалось повышенным. Значимым признавалось снижение или повышение содержания креатинина крови на 20% и более. Билатеральное стентирование почечных артерий выполнялось в 18% случаев, унилатеральное – в 82%, при этом у 8% пациентов имелась только 1 функционирующая почка. Таким образом, у 26% пациентов, включенных в исследование, вазоренальная гипертензия развивалась по модели «one-kidney-one-clip». Эти данные коррелируют с результатами других исследований по ВРГ. При изучении функции почек до и после стентирования была выявлена тенденция к стабилизации уровня креатинина крови после реваскуляризации. Этот показатель за период наблюдения оставался неизменным или снижался у 72% пациентов, повышение креатинина крови было отмечено только у 28% больных. При этом прогностическими факторами, позволяющими предположить улучшение функции почек после стентирования (снижения концентрации креатинина крови на 20% и более от исходного) были первоначальный уровень креатинина выше 1.5 мг/дл и билатеральное поражение почечных артерий. Улучшение функции почек после стентирования отмечалось у 29% пациентов с билатеральными стенозами, в то время как среди пациентов с унилатеральными стенозами – только у 15%.
По данным T. Zeller, к благоприятным прогностическим факторам в отношении улучшения функции почек после реваскуляризации относятся уровень креатинина крови, превышающий1,5 мг/дл и сниженная фракция выброса левого желудочка [46]. Предвестниками снижения артериального давления в этом исследовании были женский пол, нормальная толщина паренхимы почек, повышенный уровень АД до процедуры. В этой же работе не было выявлено статистически достоверной связи между результатами стентирования почечных артерий и наличием у пациентов таких заболеваний, как сахарный диабет, нефросклероз, наличие одно- или двустороннего поражения почечных артерий.
Тот факт, что процедура реваскуляризации более эффективна у пациентов с билатеральным поражением почечных артерий, отмечается во многих исследованиях и объясняется различием в патофизиологических механизмах развития ВРГ при би- и унилатеральном поражении почечных артерий. La Batide-Alanore и соавторы [47] установили, что после ангиопластики почечных артерий по поводу унилатерального стеноза наблюдается рост скорости клубочковой фильтрации в реваскуляризированной почке при параллельном снижении клубочковой фильтрации в «здоровой», за счет прекращения ее патологической гиперперфузии. Таким образом, общая клубочковая фильтрация увеличивается незначительно, однако это не означает, что восстановление кровотока в почке, кровоснабжаемой стенозированной артерией не имеет смысла. Давно известно, что гиперперфузия почки и гиперфильтрация в клубочках приводят к протеинурии, которая, в свою очередь, способствует дальнейшему прогрессированию нефропатии [48]. La Batide-Alanore и соавторы пришли к выводу, что стентирование почечных артерий при унилатеральном поражении способствует устранению гиперперфузии здоровой почки, приводя тем самым к снижению протеинурии.
В работе Gray [49] изучалась эффективность интервенционных методов лечения стенозов почечных артерий у пациентов с выраженными поражениями органов-мишеней артериальной гипертензии: сердечной недостаточностью, азотемией и эпизодами острого отека легких в анамнезе. В исследование вошли 39 пациентов с гемодинамически значимыми (более 70%) стенозами почечных артерий. Во всех случаях имели место билатеральные стенозы или стенозы единственной функционирующей почки. Всем пациентам выполнялось стентирование после предилатации почечных артерий баллоном. Было зафиксировано статистически достоверное снижение АД в среднем со 174 и 85 до 148 и 72 мм рт. ст. (р<0.001). Кроме того, снизилась потребность пациентов в антигипертензивной терапии: как в количестве препаратов, так и в дозировке . Функция почек также улучшилась после интервенционного вмешательства: средняя концентрация креатинина в плазме крови в течение периода наблюдения снизилась с 3.2 мг/дл до 2.7 (р=0.06). Помимо явного прогресса в контроле артериального давления, оперативное лечение привело к снижению выраженности симптомов поражения органов–мишеней; класс сердечной недостаточности по NYHA в результате стентирования в среднем снизился с 2.9 до 1.5, а частота госпитализации в связи с симптомами этого заболевания уменьшилась с 2.4 до 0.3 в год. Таким образом, данное исследование подтверждает эффективность интервенционных методов лечения стенозов почечных артерий при наличии поражения миокарда и паренхимы почек.
Наиболее современным клиническим испытанием, посвященным проблеме эффективности стентирования почечных артерий у пациентов с ВРГ, является исследование ASTRAL (Angioplasty and STenting for Renal Artery Lesions), предварительные результаты которого были представлены в ноябре 2008 года [50]. Это самое крупное на данный момент исследование по этой тематике, т.к. в нем прослежены отдаленные (отчетный период наблюдения - 1 год) результаты лечения ВРГ у 1000 пациентов. Все они были случайным образом рандомизированы в 2 группы: пациенты из первой группы получали оптимальную консервативную терапию, пациентам из второй выполнялось стентирования почечных артерий. Конечными точками исследования были снижение АД, развитие почечной недостаточности, осложнений со стороны сердечно-сосудистой системы и общая смертность. Стентирование почечных артерий не продемонстрировало статистически достоверного преимущества перед консервативной терапией ни по одной из этих конечных точек. Однако это исследование неоднократно подвергалось критике [51] в связи с большой неоднородностью выборки пациентов. В связи с этим, делать заключение о нецелесообразности выполнения реваскуляризации почечных артерий у всех пациентов с ВРГ на основании данных ASTRAL было бы ошибочно.
Перспективные направления исследований ВРГ.
В настоящее время значительные усилия ученых, занимающихся проблемой ВРГ, направлены на выявление факторов, позволяющих спрогнозировать влияние реваскуляризации почечных артерий на течение ВРГ. Результаты некоторых исследований позволяют предположить, что одним из таких факторов может оказаться измеряемый методом дуплексного сканирования индекс сопротивления (ИС) в сегментарных артериях почек [53]. Индекс сопротивления рассчитывается по формуле: ИС=100х(1-[конечная диастолическая скорость потока/пиковая систолическая скорость потока]). Суть данной гипотезы состоит в том, что прогрессирующая ишемия почки запускает процесс неспецифического повреждения паренхимы органа, который приводит к интерстициальному фиброзу, снижению числа функционирующих нефронов и кровоснабжающих их капилляров. Эти изменения влекут за собой уменьшение плотности сосудистой сети почки и, как следствие, повышение ее сосудистого сопротивления. Таким образом, чем выше ИС, тем дальше зашел процесс фиброза в почечной ткани. По данным Radermacher, реваскуляризация почечных артерий у пациентов с ИС>80 не приводила к статистически достоверному улучшению функции почек или снижению АД, однако эти результаты не нашли подтверждения в последующих исследованиях [46].
Большая роль в прогнозировании результатов стентирования почечных артерий отводится изучению гемодинамических параметров кровотока в исследуемом сосуде. По мнению некоторых ученых реваскуляризации подлежат только стенозы с систолическим градиентом давления >20 или средним градиентом >10 мм рт.ст. [25]. Согласно другим исследованиям, более информативен в плане оценки влияния стеноза на гемодинамику такой показатель как резерв почечного кровотока (РПК). Для определения этого показателя измеряют градиент давления на стенозе до и после внутриартериального введения папаверина, отношение этих цифр и является РПК (РПК = давление за стенозом на фоне гиперемии/давление в аорте). В недавнем исследовании Subramanian и соавторы [54] выяснили, что пациенты с РПК<0.8 имеют больше шансов на снижение АД после стентирования почечных артерий (в 86% случаев), чем пациенты с РПК в пределах нормы (снижение АД отмечено только в 30% случаев). Интересно, что в этом же исследовании не выявлено корреляции между гемодинамическими параметрами стеноза (РПК, систолический и средний градиент давления) и ангиографическими (процент сужения почечной артерии). Авторы объясняют свои результаты сложностью адекватной оценки ангиографических параметров СПА при съемке в одной проекции, в особенности при устьевом поражении. Хотя эти данные представляют несомненный интерес, для оценки их достоверности необходимы дальнейшие исследования на значительно большем клиническом материале.
Заключение.
Клиническое значение ВРГ, несомненно, очень велико, оно обусловлено высокой распространенностью данного заболевания, а также его выраженным отрицательным влиянием на прогноз. Несмотря на это, выявлению ВРГ, к сожалению, по прежнему уделяется недостаточно внимания, хотя правильно собранный анамнез и тщательно проведенное физическое обследование (включающее, например, аускультацию почечных артерий) вполне позволяют заподозрить наличие у пациента именно данной формы гипертензии. В настоящее время клиническое обследование легко может быть дополнено безопасными неинвазивными методами диагностики, такими как дуплексное сканирование, КТ- и МР-ангиография, которые позволяют выявить поражение почечных артерий с высокой точностью. Таким образом, диагностика вазоренальной гипертензии на данном этапе развития медицины не составляет проблемы. Гораздо сложнее ситуация с лечением данного заболевания. Несмотря на большой клинический опыт и многочисленные публикации в научной литературе, существует не так много исследований эффективности реваскуляризации почечных артерий, которые соответствовали бы критериям доказательной медицины [55]. В связи с этим, в настоящее время общепризнанных показаний к стентированию почечных артерий не существует, и, следовательно, решение вопроса о необходимости выполнения реваскуляризации у каждого отдельного взятого пациента является прерогативой лечащего врача [56]. Остается надеяться, что новые исследования внесут ясность в данную проблему.
Литература:
1. Safian R.D., Textor S.C. Renal artery stenosis. N Engl J Med. 2001; 344:431-42.
2. Ram C.V. Renovascular hypertension. Curr Opin Nephrol Hypertens 1997; 6: 575–579.
3. Hansen K.J., Edwards M.S. et al. Prevalence of renovascular desease in eldery: a populaton based study. J Vasc Surg. 2002; 36:443-51.
4. Holley K.E., Hunt J.S. et al., Renal artery stenosis: a clinical-pathologyc study in normotensive and hypertensive patients. Am J Med. 1964; 37:14-22.
5. Rihal C.S., Textor S.C. et al. Incedental renal artery stenosis among a prospective cohort of hypertensive patients undergoing coronary angiography. Mayo Clin Proc. 2002; 77:309-316.
6. Olin J.W., Melia M., Young J.R., Graor R., Risius B. Prevalence of atherosclerotic RAS in patients with atherosclerosis elsewhere. Am J Med. 1990;88:46–51.
7. Pohl M.A. Renal artery stenosis, renal vascular hypertension and ischemicnephropathy. Diseases of the Kidney. 1997; 1367–423.
8. Garovic V.D., Textor S.C. Renovascular Hypertension and Ischemic Nephropathy. Circulation 2005; 112:1362-74.
9. Meaney T.F., Dustan H.P., McCormack L.J. Natural history of renal arterial disease. Radiology 1968; 91: 881–7.
10. Caps M.T., Perissinotto C., Zierler R.E., Polissar N.L, Bergelin R.O., Tullis M.G., Cantwell-Gab K., Davidson R.C., Strandness D.E. Prospective Study of Atherosclerotic Disease Progression in the Renal Artery Circulation 1998; 98:2866-72.
11. Schreiber M.J., Pohl M.A., Novick A.C. The natural history of atherosclerotic and fibrous renal artery disease. Urol Clin North Am 1984; 11: 383–92.
12.Tollefson DF, Ernst CB. Natural history of atherosclerotic renal artery stenosis associated with aortic disease. J Vasc Surg. 1991; 14:327–31.
13. Guzman R.P., Zierler R.E., Isaacson J.A., Bergelin R.O., Strandness D.E. Renal atrophy and arterial stenosis: a prospective study with duplex ultrasound. Hypertension 1994; 23: 346–50.
14. Connolly J.O., Higgins R.M., Walters H.L., et al. Presentation, clinical features and outcome in different patterns of atherosclerotic renovascular disease. Q J Med 1994; 87:413–21.
15. Coen G., Calabria S., Lai S. et al. Atherosclerotic ischemic renal disease. Diagnosis and prevalence in a hypertensive and/or uremic elderly population. BMC Nephrol 2003; 4: 2.
16. Guo H., Kalra P.A., Gilbertson D.T. et al. Atherosclerotic renovascular disease in older US patients starting dialysis, 1996 to 2001. Circulation 2007; 115: 50–8.
17. Goldblatt H., Lynch J., Hanzal R.E., Summerville W.W. Studies on experimental hypertension, I: the production of persistent elevation of systolic blood pressure by means of renal ischemia. J Exp Med. 1934; 59:347–79.
18. De Forrest J.M., Knappenberger R.C., Antonaccio M.J., Ferrone R.A., Creekmore J.S. Angiotensin II is a necessary component for the development of hypertension in the two-kidney, one clip rat. Am J Cardiol. 1982; 49:1515–7.
19. Basso N., Terragno N.A. History about the discovery of the renin-angiotensin system. Hypertension. 2001; 38:1246 –9.
20. Brunner H.R., Kirshmann J.D., Sealey J.E., Laragh J.H. Hypertension of renal origin: evidence for two different mechanisms. Science. 1971; 174:1344–6.
21. Lerman L.O., Nath K.A., Rodriguez-Porcel M., Krier J.D., Schwartz R.S., Napoli C. Increased oxidative stress in experimental renovascular hypertension. Hypertension. 2001; 37:541–6.
22. Higashi Y., Sasaki S., Nakagawa K., Matsuura H., Oshima T., Chayama K. Endothelial function and oxidative stress in renovascular hypertension. N Engl J Med. 2002; 346:1954 –62.
23. Grisk O., Rettig R. Interactions between the sympathetic nervous system and the kidneys in arterial hypertension. Cardiovasc Res. 2004; 61:238–46.
24. ACC/AHA 2005 practice guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (writing committee to develop guidelines for the management of patients with peripheral arterial disease): endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation; National Heart, Lung, and Blood Institute; Society for Vascular Nursing; TransAtlantic Inter-Society Consensus; and Vascular Disease Foundation. Circulation 2006; 113: 463–654.
25. Rundback J.H., Sacks D., Kent K.C., et al. Guidelines for the reporting of renal artery revascularization in clinical trials. American Heart Association. Circulation 2002; 106: 1572–1585.
26. Soares G.M., Murphy T.P., Singha M.S., Parada A., Jaff M. Renal artery duplex ultrasonography as a screening and surveillance tool to detect renal artery stenosis: a comparison with current reference standard imaging. J Ultrasound Med 2006; 25: 293–8.
27. Eklof H., Ahlstrom H., Magnusson A., et al. A prospective comparison of duplex ultrasonography, captopril renography, MRA, and CTA in assessing renal artery stenosis. Acta Radiol 2006; 47: 764–74.
28. Leiner T., de Haan M.W., Nelemans P.J., van Engelshoven J.M., Vasbinder G.B. Contemporary imaging techniques for the diagnosis of renal artery stenosis. Eur Radiol 2005; 15: 2219–29.
29. Chobanian A.V., Bakris G.L., Black H.R. et al. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension 2003; 42: 1206–52.
30. Dahlof B., Devereux R.B., Kjeldsen S.E. et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002;359: 995–1003.
31. Randomised placebo-controlled trial of effect of ramipril on decline in glomerular filtration rate and risk of terminal renal failure in proteinuric, non-diabetic nephropathy. The GISEN Group (Gruppo Italiano di Studi Epidemiologiciin Nefrologia). Lancet 1997; 349: 57–1863.
32. Bakris G.L., Weir M.R. Angiotensin-converting enzyme inhibitor-associated elevations in serum creatinine: is this a cause for concern? Arch Intern Med 2000; 160: 685–93.
33. Seliger S.L., Weiss N.S., Gillen D.L. et al. HMG-CoA reductase inhibitors are associated with reduced mortality in ESRD patients. Kidney Int 2002; 61: 297–304.
34. Antithrombotic Trailist’s Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71–86.
35. Fogari, R, Zoppi, A. Effect of antihypertensive agents on quality of life in the elderly. Drugs Aging 2004; 21: 377–93.
36. Krousel-Wood M., Thomas S., Muntner P., Morisky D. Medication adherence: a key factor in achieving blood pressure control and good clinical outcomes in hypertensive patients. Curr Opin Cardiol 2004; 19: 357–62.
37. Gruntzig A., Vetter W., Meier B., Kuhlmann U., Lutolf U., Siegenthaler W. Treatment of renovascular hypertension with percutaneous transluminal dilation of a renalartery stenosis. Lancet 1978; 311: 801–2.
38. Tegtmeyer C.J., Brown J., Ayers C.A., Wellons H.A., Stanton L.W. Percutaneous transluminal angioplasty for the treatment of renovascular hypertension. JAMA 1981; 246: 2068–70.
39. Rees C.R., Palmaz J.C., Becker G.J. et al. Palmaz stent in atherosclerotic stenoses involving the ostia of the renal arteries: preliminary report of a multicenter study. Radiology 1991; 181: 507–14.
40. Murphy T.P., Soares G., Kim M. Increase o f utilization of percutaneous renal artery interventions. American Journal of roentgenology. 2004;183:561-8.
41. Baumgartner I., von Aesch K., Do D-D., Triller J., Birrer M., Mahler F.. Stent Placement in Ostial and Nonostial Atherosclerotic Renal Arterial Stenoses: A Prospective Follow-up Study. Radiology 2000; 216:498–505.
42. van de Ven P.J., Kaatee R., Beutler J.J. et al. Arterial stenting and balloon angioplasty in ostial atherosclerotic renovascular disease: a randomised trial. Lancet 1999; 353:282–6.
43. Harden PN, MacLeod MJ, Rodger RSC, et al. Effect of renal-artery stenting on progression of renovascular renal failure. Lancet. 1997;349: 1133–6.
44. Gill-Leertouwer TC, Gussenhoven EJ, Bosch JL, et al. Predictors for clinical success at one year following renal artery stent placement. J Endovasc Ther. 2002; 9:495–502.
45. Bates M.C, Campbell J.E., Broce M., Lavigne Ph.S., Riley M.A. Serum creatinine stabilization following renal artery stenting. Vasc Endovascular Surg 2008; 42-40.
46. Zeller T., Ulrich F., Muller C., Burgelin K., Sinn L. Angioplasty of severe atherosclerotic ostial renal artery stenosis: predictors of improved renal function after percutaneous stent-supported intervention. Circulation 2003;108;2244-9.
47. La Batide-Alanore A, Azizi M, Froissart M, et al. Split renal function outcome after renal angioplasty in patients with unilateral renal artery stenosis. J Am Soc Nephrol. 2001;12:1235-41.
48. Lindeman RD. Overview: renal physiology and pathophysiology of aging. Am J Kidney Dis. 1990; 16:275-82.
49. Gray B.H., Olin J.W., Childs M.B., Sullivan T.M., Bacharach J.M. Clinical benefit of renal artery angioplasty with stenting for the control of recurrent and refractory congestive heart failure. Vasc Med 2002; 7; 275.
50. Wheatley K. Lack of benefit of renal artery revascularization in atherosclerotic renovascular disease (ARVD): Results of the ASTRAL trial. American Society of Nephrology 41st Annual Meeting and Scientific Exposition. November 7, 2008.
51. Main J. The problem with ASTRAL. Journal of Renovascular Disease 2002; 1:19–20.
52. Cooper C.L, Murphy T.P., Matsumoto A., Steffes M., Cohen D.J., Jaff M., Kuntz R., Jamerson K., Reid D., Rosenfeld K., Runback J., D`Agostino R., Henrich W., Dworkin L. Stent revascularization for the prevention of cardiovascular and renal events among patients with renal artery stenosis and systolic hypertension: rationale and design of the CORAL trial. Am Heart J 2006; 152:59-66.
53. Radermacher J., Chavan A., Bleck J. et al. Use of Doppler ultrasonography to predict the outcome of therapy for renal-artery stenosis. N Engl J Med 2001; 344: 410–17.
54. Subramanian R., White C.J., Rosenfield K. et al. Renal fractional flow reserve: a hemodynamic evaluation of moderate renal artery stenoses. Catheter Cardiovasc Interv 2005; 64: 480–6.
55. Dubel G.J., Murphy T.P. The role of percutaneous revascularization for renal artery stenosis. Vascular Medicine 2008; 13: 141–56.
56. Rocha-Singh K.J., Eisenhauer A.C., Textor S.C., Cooper C.J., Tan W.A., Matsumoto A.H., Rosenfield K. Aterosclerotic peripheral vascular disease symposium II: intervention for renal artery disease. Circulation 2008; 118:2873-8.