Цель обзора. Описать роль ингибиторов гидроксиметилглутарил-КоА-редуктазы в снижении частоты сердечно-сосудистой заболеваемости и смертности с позиций доказательной медицины и возможность применения статинов у больных с неалкогольной жировой болезнью печени в рамках метаболического синдрома.
Сердечно-сосудистые заболевания служат основными причинами инвалидизации и смертности во всём мире. В основе патогенеза этих заболеваний лежит атеросклероз – одна из главнейших проблем современной медицины. В достаточно большом количестве исследований была показана возможность снижения частоты сердечно-сосудистой заболеваемости и смертности вплоть до 42% за счёт снижения уровня липопротеидов низкой плотности. Это стало возможным благодаря применению основного класса гиполипидемических препаратов - статинов. Уникальность статинов заключается не только в способности значимо снижать синтез холестерина, но и в наличии у них целого ряда других свойств, объединенных под названием «плейотропных эффектов». В связи с неуклонным ростом пациентов с метаболическим синдромом, высоким риском сердечно-сосудистых осложнений, назначение статинов неизбежно. Известно, что атерогенная дислипидемия у таких пациентов в большинстве случаев сочетается с неалкогольной жировой болезнью печени. В России приверженность к терапии статинами крайне низкая (в 2001 году только 0,6% больных острым инфарктом миокарда принимали статины). Среди множества возможных причин недостаточного использования статинов в нашей стране сохраняет актуальность вопрос безопасности назначения этого класса препаратов. Результаты проведённых исследований показывают, что у лиц с исходно повышенным уровнем печёночных трансаминаз в силу различных причин приём статинов не вызывает повышенного риска гепатотоксичности (клинически значимое повышение активности печеночных ферментов у 0,8% больных против 0,6% случаев в группе плацебо). Также имеются данные о том, что эффективность комбинации малых доз статинов и урсодезоксихолевой кислоты выше, чем использование удвоенной дозы статинов. В статье рассмотрены вопросы необходимости и безопасности применения статинов у больных с неалкогольной жировой болезнью печени.
Заключение. Назначение статинов для первичной и вторичной профилактики заболеваний сердечно-сосудистой системы сможет предотвратить десятки тысяч преждевременных смертей. Результаты большого числа исследований позволяют говорить об эффективности и безопасности назначения симвастатина пациентам с неалкогольной жировой болезнью печени в рамках комплексной терапии метаболического синдрома Совместное применение статинов и урсодезоксихолевой кислоты обосновано в качестве патогенетической терапии НАЖБП, а также гиполипидемической терапии у больных с метаболическим синдромом.
Сердечно-сосудистые заболевания (ССЗ) (ишемическая болезнь сердца - ИБС, цереброваскулярная болезнь, окклюзивные заболевания периферических артерий) служат основными причинами инвалидизации и смертности во всём мире. В основе патогенеза этих заболеваний лежит атеросклероз – одна из главнейших проблем современной медицины. История пристального изучения сущности процессов, лежащих в основе атеросклероза, длится уже более века. В настоящее время имеется чёткое представление об атеросклерозе как мультифакториальном заболевании, динамичном процессе, прогрессирующем в сосудистой системе десятилетиями и имеющем возможность обратного развития изменений в стенке артерии. Со временем процесс неумолимо прогрессирует, нередко проявляясь внезапно, зачастую фатально (внезапная коронарная смерть или инфаркт миокарда).
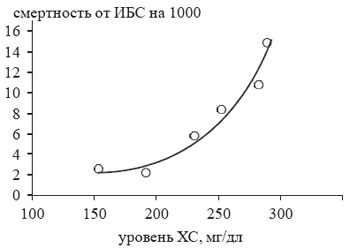
Как известно, большинство случаев ИБС возникает на фоне длительного сосуществования факторов риска, среди которых особое значение имеют нарушения липидного обмена. Утверждение «без атерогенных липопротеидов не будет атеросклероза» [1] подтверждают результаты наиболее крупных эпидемиологических исследований (Фремингемское, MRFIT, исследование 7 стран), в которых была показана отчетливая прямая корреляция между концентрацией холестерина в крови и уровнем смертности от ИБС (рис. 1) [2-4].
Рисунок 1. Показатели смертности от ИБС в зависимости от уровня ХС.(Данные исследования MRFIT)
Нарушения липидного обмена играют одну важную роль в патогенезе заболеваний, ассоциированных с атеросклерозом. Наглядным доказательством этому могут служить результаты недавно завершившегося международного исследования INTERHEART, в которое были включены 15152 пациента с острым инфарктом миокарда (случай) и 14820 людей без явных признаков ишемической болезни сердца (контроль) из 52 стран мира [5]. Целью этого исследования было изучение взаимосвязи острого коронарного синдрома и 9 факторов риска (дислипидемия, курение, артериальная гипертензия, ожирение, сахарный диабет, стресс/депрессия, употребление алкоголя, потребление овощей и фруктов и физическая активность). Оказалось, что вне зависимости от пола, национальности и социально-этнических условий в развитии острого инфаркта миокарда дислипидемия занимает первое место среди всех факторов риска [6].
Во Фремингемском проспективном эпидемиологическом исследовании, которое началось в 50-е годы прошлого столетия и продолжается до сих пор, были определены оптимальные уровни липопротеидов высокой плотности (ЛПНП), общего холестерина (ОХС), триглицеридов (ТГ) и липопротеидов высокой плотности (ЛПВП), как основных липидных факторов риска кардиоваскулярных исходов атеросклероза. Однако результаты исследований последнего десятилетия свидетельствуют о неравнозначном вкладе различных классов липидов в риск ССЗ. Например, во внутрипопуляционном исследовании PROCAM (Prospective Cardiovascular Munster Study) была доказана опасность ассоциации низкого уровня ЛПВП, гипертриглицеридемии и умеренно повышенных значений уровня ЛПНП [7]. В проспективном исследовании AMORIS (Apolipoprotein Mortality Risk Study) получено подтверждение того, что Апo B является более чувствительным маркером риска ССЗ, а размеры и плотность частиц ЛПНП - более сильные предикторы неблагоприятных сосудистых событий, чем ОХС и ЛПНП. Также доказано, что отношение АпоВ/АпоА-1 является наиболее мощным предиктором риска развития ишемического инсульта [8].
В достаточно большом количестве исследований была показана возможность снижения частоты ССЗ и смертности вплоть до 42% за счёт снижения уровня ЛПНП [9-13]. Это стало возможным благодаря применению нового класса гиполипидемических препаратов - статинов.
Открытие и внедрение в практику ингибиторов гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоАредуктазы) - основного фермента, регулирующего биосинтез холестерина в гепатоцитах, стало одним из самых ярких достижений второй половины XX века. Создав в 1976 году первый статин, японский исследователь Akira Endo вряд ли мог даже предположить, что спустя 30 лет его назовут «открывателем «пенициллина» для холестерина» (discaverer of a «Penicillin for cholesterol») [14]. Совершенно два разных класса препаратов совершили революционный переворот в медицине: применение антибиотиков предотвратило смертельные исходы миллионов людей от инфекций, а под влиянием статинов стала уязвимой самая распространённая, многоликая опасная болезнь – атеросклероз.
Многочисленные крупнейшие многоцентровые плацебо-контролируемые исследования (4S, CARE, LIPID, WOSCOPS, AF CAPS/TexCAPS, HPS, CARDS и др.) доказали высокую эффективность статинов при атерогенной дислипидемии в аспекте снижения частоты сердечно-сосудистых осложнений, в том числе снижения риска преждевременной смерти у больных с клиническими проявлениями атеросклероза [15-18].
Основополагающим среди этих работ следует считать скандинавское исследование 4S (Scandinavian Simvastatin Survival Study). Это было первое длительное (5,4 года) плацебо-контролируемое исследование с использованием симвастатина (использовался препарат “Зокор”) 20–40 мг/сут, в котором участвовало 4444 человека с ИБС. В этой работе впервые изучалось влияние лечения симвастатином на сердечно-сосудистую и общую смертность. Исследуемая популяция – больные ИБС после инфаркта миокарда в анамнезе, в возрасте 35–70 лет, с исходным уровнем общего холестерина 213–309 мг/дл. Снижение уровня ЛПНП за 5 лет наблюдения составило 36%, что привело к снижению общей смертности на 30% (p=0,0003). Количество больших коронарных событий снизилось на 34%, сердечно-сосудистая смертность – на 42%, необходимость в операциях ревакуляризации миокарда – на 37%. Это исследование во многом развеяло сомнения о необходимости гиполипидемической терапии у больных ИБС с целью профилактики ее осложнений и ответило на многие вопросы по безопасности такого лечения. Результаты этого эпохального исследования в значительной мере способствовали развитию препаратов статинов как класса [9].
Необходимо обратиться и к исследованию HPS (Heart Protection Study) – самому крупному исследованию последнего времени, в котором участвовало 20 536 пациентов: 50% больных принимали симвастатин (использовался препарат “Зокор”), 50% – плацебо. С учетом дизайна исследования половина больных принимали антиоксидантный коктейль: витамин Е (600 мг) + витамин С (250 мг) и ?-каротин (20 мг), половина – витамины-плацебо. По основным результатам HPS прием cимвастатина в дозе 40 мг/сут в течение 5 лет позволил достоверно снизить сердечно-сосудистую смертность на 17%, частоту любого большого сердечно-сосудистого осложнения на 24% (p<0,0001) и общую смертность на 13% (p=0,0003). Среди сердечно-сосудистых причин смерти наибольшая польза от лечения симвастатином была получена при снижении комбинированной конечной точки (риск первого нефатального инфаркта и внезапной смерти) на 27% (p<0,0001). Терапия симвастатином оказала существенное влияние на частоту фатального и нефатального инсульта независимо от этиологии (-25%) и необходимость операций реваскуляризации (-24%). Влияние результатов HPS на мировую клиническую практику трудно переоценить. Впервые было показано, что снижение уровня ЛПНП на 1 ммоль/л связано со снижением общей смертности, как в первичной, так и вторичной профилактике ИБС и эта польза не зависит от пола, возраста, исходных значений липидов и степени снижения ЛПНП. Впервые в проспективном исследовании была убедительно показана клиническая польза применения симвастатина у больных с артериальной гипертензией (АГ), сахарным диабетом 2 типа (СД 2 типа), с экстракоронарным атеросклерозом [19, 20].
Уникальность статинов заключается не только в способности значимо снижать синтез холестерина, но и в наличии у них целого ряда других свойств, объединенных под названием «плейотропных эффектов». Разнообразие плейотропных эффектов статинов вероятно в недалёком будущем позволит использовать этот класс препаратов для лечения не только кардиологических пациентов. Экспериментальные и клинические данные всё больше дают доказательств, свидетельствующих о необходимости расширения «терапевтической ниши» статинов. Наибольшее значение имеют такие плейотропные эффекты статинов, как: улучшение эндотелиальной функции (это свойство статинов проявляется уже при малых дозах и для этого не требуется продолжительных сроков лечения), ингибирование пролиферации и миграции гладкомышечных клеток; снижение агрегации тромбоцитов, противовоспалительное действие, улучшение состояния фибринолитической системы. Появляется всё больше данных об эффективности статинов у лиц с болезнью Альцгеймера, рассеянным склерозом, хронической сердечной недостаточностью, почечной недостаточностью [21-26]. Корейские ученые на экспериментальных моделях мышей при анализе влияния симвастатина на рост опухоли получили результаты, свидетельствующие о противоопухолевом потенциале симвастатина в отношении рака толстой кишки [27].
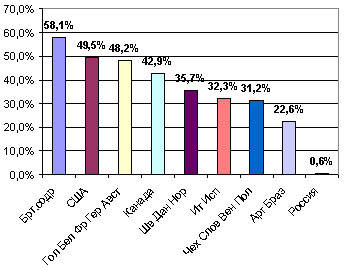
«В лице» статинов врачи получили эффективное и безопасное средство стационарного и амбулаторного применения, которое вошло в фармакопейные списки "обязательных" препаратов многих стран мира. По данным европейского исследования EUROASPIRE, в котором ведётся наблюдение за динамикой факторов риска и ССЗ, в Европе назначение статинов за последнее десятилетие возросло с 32,2% до 88,8%, однако, достижение целевых уровней ЛПНП остаётся на уровне 40%. Одной из основных проблем, как в Западной так и в Восточной Европе, является низкая приверженность пациентов к терапии статинами [28, 29]. Далеко не так радужно обстоят дела в России. По данным USA Food and drug administration от 2005 года Российская Федерация оказалась в числе мировых лидеров по потреблению лекарств (по объемам потребления готовых лекарственных средств - 12-е место в мире и 6-е в Европе). Но статины не вошли даже в десятку наиболее используемых лекарственных средств. Точной статистики, доказывающей частоту использования статинов российскими пациентами нет, однако имеющиеся отдельные данные свидетельствуют о крайне неблагоприятной ситуации, сложившейся вокруг этого класса препаратов. Так, по данным многоцентрового исследования VALIANT, в котором принимала участие и Россия, к 2001 году лишь 0,6% наших соотечественников, перенесших острый инфаркт миокарда, получали статины (рис. 2) [30].
Рисунок 2. Частота применения статинов у больных острым инфарктом миокарда в различных странах.(Данные исследования VALIANT: Nippon Rinsho. 2002 Oct; 60(10):2034-8, Am Heart J 2003 May;145 (5):754-7)
В связи с неуклонным ростом пациентов с метаболическим синдромом (МС), высоким риском сердечно-сосудистых осложнений, назначение статинов неизбежно. Известно, что атерогенная дислипидемия у таких пациентов в большинстве случаев сочетается с неалкогольной жировой болезнью печени (НАЖБП). НАЖБП является малосимптомной болезнью, не оказывающей существенного влияния на качество жизни вплоть до развития терминальных форм. В то же время основные причины смерти больных с НАЖБП связаны с сердечно-сосудистой патологией. В долговременном исследовании, проведенном в Швеции, показано, что за 15 лет наблюдения из 129 пациентов с морфологически доказанной НАЖБП, сопровождавшейся «хронической гипертрансаминаземией», 12,7% умерли от сердечно-сосудистых заболеваний, и только 1,6% - от печёночной патологии [31]. Поэтому НАЖБП, как одно из проявлений МС, могла бы стать самостоятельной нишей для статинов в гепатологии.
Среди множества возможных причин недостаточного использования статинов в нашей стране сохраняет актуальность вопрос безопасности назначения этого класса препаратов. Исследование Chalasani N. с соавт. продемонстрировало, что у лиц с исходно повышенным уровнем печёночных трансаминаз в силу различных причин приём статинов не вызывает повышенного риска гепатотоксичности [32-34]. Исследование HPS, проводимое с включением более 20 тыс. человек, длительно получавших симвастатин, показало относительную безопасность их приема - клинически значимое повышение активности печеночных ферментов отмечалось у 0,8% больных (против 0,6% случаев в группе плацебо).
Существует ли риск гепатотоксичности статинов при лечении дислипидемии у пациентов с МС? Известно, что повышение печёночных ферментов – наиболее частый побочный эффект статинов – наблюдается в 0,5-2% случаев и зависит от дозы препарата. Хотя заболевания печени и стоят в перечне противопоказаний для применения статинов, до сих пор не описаны случаи ухудшения течения заболеваний печени на фоне приёма этого класса лекарственных препаратов. Существует ряд исследований, результаты которых показали эффективность и безопасность использования статинов в лечении атерогенной дислипидемии у больных с МС [31, 33-36].
Согласно Докладу Комитета по безопасности лечения статинами Национальной Липидной Ассоциации США терапия статинами может быть рекомендована пациентам с хроническими болезнями печени, неалкогольным стеатогепатитом, жировой инфильтрацией печени под тщательным контролем уровня активности печёночных ферментов [37].
Если больному показан приём статинов, а уровень печёночных трансаминаз превышает 2-3-кратную норму, то на помощь клиницисту может прийти урсодезоксихолевая кислота (УДХК). Назначение УДХК патогенетически обоснованно при НАЖБП [38, 39]. УДХК представляет собой лекарственный препарат плейотропного действия, что выражается в наличии холеретического, цитопротективного, иммуномодулирующего, антиапоптотического, гипохолестеринемического и литолитического механизмов действия. Применение УДХК при НАЖБП с повышенным уровнем трансаминаз в дозе 10-15 мг/кг в сутки, длительностью 6 месяцев и более оказывает положительное влияние на биохимические показатели, ведёт к снижению активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ), гаммаглутамилтранспептидазы (ГГТ) и уменьшению выраженности стеатоза и воспаления по данным гистологического исследования печени [40, 41]. После нормализации уровня АСТ, АЛТ на фоне приёма УДХК больному можно назначать статины.
В литературе также имеются данные о том, что эффективность комбинации малых доз статинов и УДХК выше, чем использование удвоенной дозы статинов. В испанском исследовании при комбинированной терапии симвастатином 20мг/сут и УДХК 300мг/сут в течение 4 месяцев, по сравнению с монотерапией симвастатином 40мг/сут, было достигнуто более выраженное снижение уровня ЛПНП (р=0,0034). Аналогичный результат был получен в этом же исследовании в группе больных, принимавших аторвастатин в дозе 20мг/сут и УДХК 300мг/сут в течение 4 месяцев, по сравнению с монотерапией аторвастатином 40мг/сут (р=0,0037). [42].
Нужно отметить, что исследования, в которых изучалась комбинированная терапия статинов и УДХК, немногочисленны, но вместе с тем, добавление УДХК в схему гиполипидемической терапии статинами у больных с НАЖБП оправдано.
Приводим клиническое наблюдение [43].
Больная Д., 73 лет, поступила в отделение реанимации и интенсивной терапии клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии имени В.Х. Василенко (директор клиники – академик РАМН, профессор В.Т. Ивашкин) в декабре 2007 года с жалобами на:
- ощущение тяжести за грудиной;
- выраженную головную боль в затылочной области на фоне повышения АД максимально до 240 и 110мм рт.ст.;
- приступы ночного удушья;
- боли в ногах при ходьбе, похолодание стоп;
- отёки голеней и стоп;
- общую слабость, быструю утомляемость.
Из анамнеза известно, что после вторых родов в 35 лет стала отмечать значительную прибавку в весе. С 44 лет стали беспокоить головные боли на фоне повышения АД до 180 и 90 мм.рт.ст., по поводу чего наблюдалась у врача по месту жительства, лечилась нерегулярно, цифры АД оставались повышенными. В 1998 году в возрасте 63 лет впервые появилось чувство тяжести за грудиной, возникающее при умеренной физической нагрузке и проходящее в покое. Не обследовалась, регулярной терапии не получала. В 2000 году в возрасте 65 лет больная перенесла лапароскопическую холецистэктомию по поводу калькулёзного холецистита, тогда же было выявлено повышение уровня глюкозы, рекомендовано обращение к эндокринологу. Однако больная больше к врачам не обращалась, не лечилась. Значительное ухудшение самочувствия в течение последних 8 месяцев, когда стали нарастать вышеуказанные жалобы. По тяжести состояния больная была госпитализирована в отделение реанимации и интенсивной терапии клиники.
Пациентка не курит, ведёт малоподвижный образ жизни, пищевое поведение – чрезмерное. Семейный анамнез отягощен по ССЗ: мать и отец страдали ГБ и СД 2 типа, умерли в возрасте 67 и 69 лет соответственно.
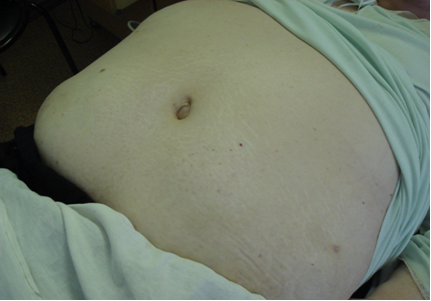
При поступлении: общее состояние средней тяжести. Сознание ясное. Обращало на себя внимание наличие абдоминального ожирения: масса тела 123кг, ИМТ = 45,2 кг/м2 (морбидное ожирение), Обхват талии (ОТ) =153см, обхват бедер (ОБ) =168см, ОТ/ОБ =0,91. Кожные покровы бледно-розового цвета. Умеренный цианоз губ. Ксантелазмы на верхних веках. Положительный симптом Фрэнка. Отеки голеней и стоп. Пульсация сосудов нижних конечностей резко снижена. При перкуссии грудной клетки ясный лёгочный звук с коробочным оттенком. Дыхание ослабленное везикулярное, ниже угла лопаток с обеих сторон выслушиваются влажные незвонкие мелкопузырчатые хрипы в умеренном количестве. ЧДД 22 в мин. При осмотре область сердца не изменена. Границы относительной тупости сердца смещены влево на 1,5см кнаружи от срединно-ключичной линии. При аускультации I тон ослаблен, акцент II тона над аортой, систолический шум на аорте с проведением на сонные артерии, короткий систолический шум на верхушке. Пульс ритмичный, ЧСС 81 уд. в мин., p. durus, АД 230 и 100 мм. рт. ст. Живот значительно увеличен в размерах за счет избыточного подкожно-жирового слоя, видны множественные стрии белесого цвета, мягкий, безболезненный при пальпации (рис. 3). При перкуссии печень на 2 см ниже края рёберной дуги по правой срединно-ключичной линии. Симптом поколачивания по поясничной области отрицателен с обеих сторон.
Рисунок 3. Абдоминальное ожирение у больной Д., 73 лет.
В отделении реанимации и интенсивной терапии при исследовании уровня кардиоспецифических ферментов и ЭКГ в динамике острое очаговое повреждение миокарда было исключено. На фоне проводимой терапии (антиагреганты, антикоагулянты, нитраты, антигипертензивные препараты) тяжесть за грудиной и приступы ночного пароксизмального удушья не рецидивировали, уменьшилась одышка, повысилась толерантность к физическим нагрузкам, уменьшились отёки голеней и стоп. Однако сохранялась артериальная гипертензия на уровне 160-180 и 90мм рт.ст. Для дальнейшего обследования и подбора терапии больная была переведена в отделение кардиологии.
При лабораторно-инструментальном обследовании в отделении кардиологии были выявлены:
- в биохимическом анализе крови признаки атерогенной дислипидемии: ОХС – 284 мг/дл, ТГ – 345 мг/дл, ЛПВП – 45 мг/дл, ЛПНП – 172 мг/дл, ЛПОНП – 67 мг/дл; индекс атерогенности – 5.3, тип дислипидемии – IIb.
- повышен уровень АЛТ (76 ед/л), АСТ (70ед/л), индекс де Ритиса 0,92.
- с целью неинвазивного определения вероятности развития фиброза у больной с метаболическим синдромом, страдающей неалкогольной жировой болезнью печени применяли тест APRI, расчёт которого проводили по формуле: АСТ ? 100 / ((верхний предел АСТ) ? тромбоциты (10^9/л) = 0,58 (вероятность мала).
- показатели инсулинового обмена: глюкоза - 138 мг/дл, ИРИ – 29 МкМЕ/мл, С-пептид – 1680пмоль/л. Рассчитывали количественный контрольный индекс чувствительности к инсулину – QUICKI – тест (QUICKI=1/[log(I0)+log(G0)], где I0 – базальное содержание инсулина в крови, G0 – базальное содержание глюкозы в крови): 0,278, что подтверждало наличие высокой степени инсулинорезистентности. У больной диагностирован СД 2 типа, средней тяжести, в стадии субкомпенсации.
- ЭКГ – синусовый ритм с ЧСС 84 в мин., признаки гипертрофии ЛЖ.
- Эхо-КГ – атеросклероз аорты, гипертрофия миокарда левого желудочка (МЖП – 1,35см, ЗС ЛЖ – 1,2см), ФВ 42%. Стеноз устья аорты атеросклеротического генеза.
- суточное мониторирование АД: тип пациента – non-dipper.
- УЗИ органов брюшной полости: печень не увеличена, контуры ровные, паренхима гиперэхогенная с явлениями выраженной жировой инфильтрации. Желчный пузырь удалён. Поджелудочная железа не увеличена, контуры нечёткие, паренхима повышенной эхогенности. Селезёнка не увеличена. Почки – без особенностей.
На основании жалоб, анамнеза, объективного исследования, данных лабораторно-инструментальных методов обследования был сформулирован следующий клинический диагноз:
Сочетанные заболевания:
Ишемическая болезнь сердца: стенокардия напряжения III Ф.К.
Сахарный диабет 2 типа, средней тяжести, фаза субкомпенсации.
Фоновые заболевания: Гипертоническая болезнь II стадии, очень высокого риска. Атеросклероз аорты, коронарных, мозговых артерий. Атеросклеротический порок сердца: стеноз устья аорты. Атеросклеротический кардиосклероз. Абдоминальное ожирение 3 степени. Дислипидемия IIb типа.
Осложнения основного заболевания: НК 2Б стадии. NYHA III ф.кл.
Сопутствующие заболевания: Желчнокаменная болезнь: лапароскопическая холецистэктомия в 2000 году.
Больной были даны диетические рекомендации, объяснена необходимость дозированной физической нагрузки. Газначена комбинированная антигипертензивная терапия (индапамид 2,5 мг/сут, лизиноприл 10 мг/сут, амлодипин 5 мг/сут), пролонгированные мононитраты (мономак 40 мг/сут), метформин 1000 мг/сут, антиагреганты (аспирин в дозе 100 мг/сут). Кроме того, учитывая наличие у больной атерогенной дислипидемии, а также признаков неалкогольного стеатогепатита, была назначена комбинированная гиполипидемическая терапия (симвастатин 40 мг/сут + препарат урсодезоксихолевой кислоты в дозе 1250 мг/сут). В данной комбинации препарат урсодезоксихолевой кислоты выступил также в роли патогенетического лечения неалкогольного стеатогепатита.
За время наблюдения в клинике на фоне проводимой терапии отмечалась положительная динамика в состоянии больной: ангинозные боли и одышка не беспокоили, повысилась толерантность к физическим нагрузкам, значительно уменьшились отёки голеней и стоп, уменьшилась общая слабость. Пациентка была выписана с рекомендациями продолжения вышеуказанного лечения и регулярного наблюдения в амбулаторных условиях.
При амбулаторном обследовании через 1 месяц: жалоб нет, АД 160 и 90мм рт.ст., АСТ 54 ед/л, АЛТ 61 ед/л, КФК 87 ед/л.
При амбулаторном обследовании через 3 месяца: новых жалоб нет, АД 150/80 мм рт.ст., ангинозные приступы не рецидивировали, показатели липидного обмена несколько улучшились. Учитывая сохраняющуюся выраженную атерогенную дислипидемию, доза симвастатина была увеличена до 60 мг/сут. При контроле сывороточных трансаминаз: АСТ 51 ед/л, АЛТ 55 ед/л.
При проведении повторного обследования ещё через 3 месяца (спустя 6 месяцев от начала лечения): ангинозные приступы не беспокоят, периферических отёков нет, уменьшились боли в ногах при ходьбе, несколько повысилась толерантность к физическим нагрузкам. Пациентка снизила массу тела с 123 до 119кг, ОТ =149см, ОТ/ОБ =0,89, ИМТ =43,7. АД 135 и 80мм рт.ст. Улучшились лабораторные показатели: АСТ 40 ед/л, АЛТ 44 ед/л, КФК 74 ед/л, индекс APRI уменьшился до 0,34. Целевые значения липидов крови пока не достигнуты, однако показатели липидного обмена значительно улучшились: ОХС – 248 мг/дл, ТГ – 210 мг/дл, ЛПВП – 55 мг/дл, ЛПНП – 157 мг/дл, ЛПОНП – 36 мг/дл; индекс атерогенности – 3,5. Нормализовался уровень глюкозы (гликемия натощак = 100 мг/дл), уменьшилась степень инсулинорезистентности (QUICKI – тест =0,296). При контрольном УЗИ органов брюшной полости – уменьшилась степень жировой инфильтрации печени: с выраженной до умеренной. Пациентка продолжает регулярный приём подобранной терапии, наблюдение в нашей клинике.
Данное клиническое наблюдение демонстрирует больную с множественной сочетанной патологией в рамках МС. Обращают на себя внимание следующие клинические особенности, связанные с трудностями подбора терапии:
- пожилой возраст больной;
- наличие морбидного ожирения;
- атерогенная дислипидемия с выраженными клиническими проявлениями;
- выраженная артериальная гипертензия;
- высокая степень инсулинорезистентности;
- наличие сочетанной патологии, в том числе неалкогольная жировая болезнь печени.
Однако улучшение состояния больной и положительная динамика лабораторно-инструментальных показателей на фоне соблюдения немедикаментозных мер и регулярного приёма комбинированной терапии свидетельствует об успехе в лечении МС и у пожилых пациентов. Кроме того, данное наблюдение подчёркивает необходимость (эффективность и безопасность) назначения гиполипидемической терапии (в данной ситуации использовалась комбинация препаратов, влияющих на липидный обмен: симвастатин и УДХК) для лечения атерогенной дислипидемии у пожилых больных.
Увеличение использования статинов для первичной и вторичной профилактики заболеваний сердечно-сосудистой системы ежегодно сможет предотвратить десятки тысяч преждевременных смертей. В настоящее время есть убедительные научные доказательства и клинические данные, подтверждающие необходимость включения статинов (в первую очередь симвастатина) в обязательный список препаратов для активной профилактики и лечения атеросклероза. Результаты большого числа исследований позволяют говорить об эффективности и безопасности назначения симвастатина пациентам с неалкогольной жировой болезнью печени в рамках комплексной терапии метаболического синдрома. Хочется верить, что в скором будущем статины займут достойное место в первой десятке жизненно необходимых препаратов в нашей стране.
Литература
1. Климов А.Н., Никульчева Н.Г. Липиды, липопротеиды и атеросклероз. CПб: Питер Пресс. 1995. с. 156-159.
2. Dawber T.R. The Framingham Study: The Epidemiology of Atherosclerotic Disease. Cambridge, MA: Harvard Univ Pr; 1980.
3. Multiple Risk Factor Intervention Trial Research Group. Am J Cardiol. 1985; 55: 1–15.
4. Verschuren WMM, Jacobs DR, Bloemberg BPM, Kromhout D, Menotti A, et al. Semm total cholesterol and long-term coronary heart disease mortality in different cultures. Twenty-five-year follow-up of the Seven Countries study. JAMA. 1995; 274:131-6.
5. Yusuf S., Hawken S., Ounpuu S. et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (The INTERHEART study). Lancet. 2004; 364: 937-52.
6. McQueen M.J., Hawken S., Wang X. et al. Lipids, lipoproteins, and apolipoproteins as risk markers of myocardial infarction in 52 countries (the INTERHEART study): a case-control study. Lancet. July 19, 2008; 372: 224–33.
7. Assmann G, Cullen P, Schulte H. Simple scoring scheme for calculating the risk of acute coronary events based on the 10-year follow-up of the prospective cardiovascular Munster (PROCAM) study. Circulation. 2002; 105:310–15.
8. Holme I. et al. Relationships between lipoprotein components and risk of myocardial infarction: age, gender and short versus longer follow-up periods in the Apolipoprotein Mortality Risk Study (AMORIS). J Intern Med. 2008 Jul. 264 (1):30-8.
9. Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet. 1994; 344:1383–9.
10. The long-term prevention with pravastatin in ischemic disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med. 1998; 339:1349–57.
11. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk patients: a randomized placebo-controlled trial. Lancet. 2002; 360:7–22.
12. ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. The Antihypertensive and Lipid Lowering Treatment to Prevent Heart Attack Trial. (ALLHAT-LLT). 2002; 288:2998–3007.
13. Sever PS, Dahlof B, Poulter NR et al. ASCOT investigators. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower than average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial Lipid Lowering Arm. (ASCOT –LLA): a multicentre controlled lipid-lowering trial. Lancet. 2003; 361:1149–58.
14. Аронов Д.М. Триумфальное шествие статинов. Трудный пациент. 2007; 5(4): 33-7.
15. Васюк Ю.А., Атрощенко Е.С., Ющук Е.Н. Плейотропные эффекты статинов – данные фундаментальных исследований. Сердце. 2005; 5 (5): 230-3.
16. Сусеков А.В. Ингибиторы ГМГ-КоА-редуктазы при вторичной профилактике атеросклероза: 30 лет спустя. Consilium Medicum. 2006; 7 (11): 24-7.
17. Сусеков А.В., Зубарева М.Ю., Деев А.Д. и др. Основные результаты Московского Исследования по Статинам. Сердце. 2006; 5 (6): 324-8.
18. Eidelman R.S., Lamas G.A., Hennekens C.H. The New National Cholesterol Education Program Guidelines. Clinical Challenges for More Widespread Therapy of Lipids to Treat and Prevent Coronary Heart Disease. Arch Intern Med. 2002; 162: 2033-6.
19. Collins R. Heart Protection Study - Main results. Late-breaking clinical trails. American Heart Association. Scientific Sessions 2001. 13 November 2001. Anaheim. California. USA.
20. Heart Protection Study Collaborative Group. Lifetime cost-effectiveness of simvastatin in a range of risk groups and age groups derived from a randomised trial of 20536 people. BMJ 2006; 333:1145-48.
21. Alegret M., Silvestre J.S. Pleiotropic effects of statins and related pharmacological experimental approaches. Methods Find Exp Clin Pharmacol. 2006 Nov; 28(9): 627–56.
22. Marcetou M. E., Zacharis E. A., Nokitovich D. et al. Early effects of simvastatin versus atorvastatin on oxidative stress and proinflammatory cytokines in hyperlipidemic subjects. Angiology. 2006; 57:211–8.
23. Аронов Д. М. Симвастатин. Новые данные и перспективы. М.: Триада Х, 2002, 80 с.
24. Briel M., Schwartz G. G., Thompson P. L. et al. Effects of early treatment with statins on short-term clinical outcomes in acute coronary syndromes: a meta-analysis of randomized controlled trial. JAMA. 2006;
295:2046–56.
25. Krysiak R., Okopie B., Herman Z. Effects of HMG-CoA reductase inhibitors on coagulation and fibrinolysis processes. Drugs. 2003; 63:1821–54.
26. Bickel C., Rupprecht H. J., Blankenberg S. et al. Relation of markers of inflammation (C-reactive protein, fibrinogen, von Willebrand factor, and leukocyte count) and statin therapy to long-term mortality in patients with angiographically proven coronary artery disease. Am J Cardiol. 2002; 89:901–8.
27. Cho S. J., Kim J. S., Kim J. M. et al. Simvastatin induces apoptosis in human colon cancer cells and in tumor xenografts and attenuates colitis-associated colon cancer in mice. Int J Cancer. 2008; 123 (4): 951–57.
28. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации (IV пересмотр). Кардиоваскулярная терапия и профилактика. 2009; 8(6); Приложение 3.
29. Kotseva K, Wood D, De Backer G, et al. EUROASPIRE III: A survey on the lifestyle, risk factors and use of cardioprotective drug therapies in coronary patients from twenty-two European countries. Eur J Cardiovasc Prev Rehabil 2009.
30. McMurray J., Solomon S. et al. The Effect of Valsartan, Captopril, or Both on Atherosclerotic Events After Acute Myocardial Infarction. An Analysis of the Valsartan in Acute Myocardial Infarction Trial (VALIANT). J Am Coll Cardiol. Feb. 21, 2006; 47:726 –33.
31. Ekstedt M. et al. Statins in non-alcoholic fatty liver disease and chronically elevated liver enzymes: a histopathological follow-up study. J Hepatol. 2007 Jul; 47(1): 135-41.
32. Chalasani N., Aljadhey H., Kesterson J. Patients with elevated liver enzymes are not at higher risk for statin hepatotoxicity. Gastroenterology. 2004; 126:1287-92.
33. Chalasani N. Statins and hepatotoxicity: focus on patients with fatty liver. Hepatology. 2005; 41(4): 690-5.
34. Brown W. Safety of statins. Curr Opin Lipidol. 2008; 19(6):558-62.
35. Лазебник Л.Б., Звенигородская Л.А., Морозов И.А., Шепелева С.Д. Клинико-морфологические изменения печени при атерогенной дислипидемии и при лечении статинами. Терапевтический архив. 2003; 8:12-5.
36. Riley P. et al. Weight loss, dietary advice and statin therapy in non-alcoholic fatty liver disease: a retrospective study. Int J Clin Pract. 2008; 62(3):374-81.
37. McKenney J., Davidson M. Final conclusions and recommendations of the National Lipid Association Statin Safety Assessment Task Force. Am J Cardiol. 2006; 97(8А): 89С-94С.
38. Angulo P. Treatment of nonalcoholic fatty liver disease. Ann Hepatol. 2002; 1(1): 12-9.
39. Siebler J., Gall P. Treatment of nonalcoholic fatty liver disease. World J Gastroenterol. 2006; 12(14): 2161-7.
40. Буеверов А.О. Возможности клинического применения урсодезоксихолевой кислоты. Consilium Medicum. 2005; 7 (6):18-22.
41. Корнеева О.Н., Драпкина О.М., Буеверов А.О., Ивашкин В.Т. Неалкогольная жировая болезнь печени как проявление метаболического синдрома. Клинические перспективы гастроэнтерологии, гепатологии. 2005; 4: 24-7.
42. Cabezas Gelabert R. Effect of ursodeoxycholic acid combined with statins in hypercholesterolemia treatment: a prospective clinical trial. Rev Clin Esp. 2004; 204(12): 632-5.
43. Буеверова Е.Л. Нарушения липидного обмена у больных с метаболическим синдромом: Дис….канд. мед. наук. Москва, 2009; 174с