Цель обзора. Проанализировать данные литературы, посвященные изучению молекулярных основ патогенеза и поиску новых перспективных мишеней в лечении возрастной макулярной дегенерации.
Результаты последних работ. Суммированы современные научные данные 26 литературных источников, преимущественно зарубежных авторов. Возрастная макулярная дегенерация (ВМД) – основная причина необратимой слепоты у пожилых людей в развитых странах. По данным Всемирной организации здравоохранения, распространенность данной патологии составляет 300 человек на 100 тысяч населения, 25-30 млн. человек в мире страдает ВМД. В связи с ростом среди населения доли лиц пожилого возраста и «омоложением» заболевания, проблема ВМД становится все более актуальной, что является мощным стимулом для проведения исследований, направленных на разработку новых перспективных подходов к лечению ВМД. Наряду с развитием и совершенствованием уже существующих методов лечения (интравитреальная анти-VEGF терапия, лазерная фотокоагуляция, фотодинамическая терапия), в качестве мишеней лекарственной терапии возрастной макулярной дегенерации активно исследуются шаперон RPE65, рецепторы активации пероксисом – PPAR, белки фибулины и эритропоэтин.
Заключение. Интенсивное исследование молекулярных механизмов болезни служит основой для совершенствования лекарственных препаратов, точкой приложения которых являются известные мишени в лечении ВМД, и открытия новых перспективных мишеней, воздействуя на которые, можно замедлить прогрессирование потери зрения у пожилых людей.
Возрастная макулярная дегенерация (ВМД) – дегенеративное, прогрессирующее заболевание макулярной области сетчатки, являющееся ведущей причиной потери центрального зрения у пожилых людей в развитых странах [1]. В структуре слабовидения ВМД занимает второе место и, как правило, сопровождается двусторонним поражением (оба глаза поражаются в 60% случаев) [2]. По данным Всемирной организации здравоохранения, распространенность данной патологии составляет 300 человек на 100 тысяч населения, 25-30 млн. человек в мире страдает ВМД. В возрасте старше 40 лет заболевают 25-40% населения, среди лиц старше 60 лет данная патология выявляется у 58% [3, 4]. Проблема развития ВМД становится все более актуальной в связи с увеличением среди населения доли людей пожилого возраста, а также в связи с «омоложением» заболевания, наблюдающемся вследствие внедрения в нашу жизнь все новых и новых компьютерных и телевизионных технологий.
Заболевание представляет собой хронический дистрофический процесс с преимущественным поражением хориокапиллярного слоя хориоидеи, мембраны Бруха и слоя пигментного эпителия сетчатки. Вследствие тесного взаимодействия структурных элементов сетчатки в патологический процесс включаются фоторецепторные клетки, что, в конечном итоге, является причиной снижения остроты центрального зрения. К факторам риска развития ВМД относят возраст, заболевания сердечно-сосудистой системы (атеросклероз и артериальная гипертензия), курение, избыточное ультрафиолетовое облучение, несбалансированное питание, светлый (голубой) цвет глаз [5]. Мутации и полиморфизм генов, которые детерминируют белки, участвующие в зрительном каскаде, факторы комплемента Н, CFB и С2, аполипопротеин Е, фибулины 3 и 5, ассоциируются с повышенным риском развития ВМД и более тяжелым ее течением [6,7]. Основными звеньями патогенеза ВМД являются процессы старения клеток сетчатки, расстройства зрительного цикла, дистрофические изменения в межклеточном матриксе, развитие иммунного воспаления, оксидативный стресс, нарушение липидного обмена и патологический ангиогенез (рис. 1) [8].
Полагают, что отправной точкой развития ВМД является накопление липофусциновых гранул в клетках пигментного эпителия, которые входят в состав так называемых друз. Причем липофусцин, как светопоглощающий пигмент, сначала может играть положительную роль для защиты сетчатки от фотоокисления, но в глазу пожилого человека концентрация липофусцина, по-видимому, достигает токсического для пигментного эпителия уровня. Основным компонентом липофусциновых гранул является вещество А2Е. В тканях глаза А2Е образуется из-за неспособности клеток пигментного эпителия полностью перевести весь транс-ретиналь в 11-цис-ретиналь. Дополнительным источником А2Е являются диски наружных сегментов фоторецепторов, которые путем фагоцитоза попадают в клетки пигментного эпителия, где А2Е образуется в результате действия ферментов фаголизосом. А2Е имеет пиридиниевую бисретиноидную структуру, которая, однажды образовавшись, не может быть подвержена ферментативному разрушению. Достигнув достаточной концентрации, А2Е может оказывать детергентоподобные эффекты на клеточные мембраны, нарушать функционирование лизосом и высвобождать проапоптозные белки из митохондрий. А2Е повышает чувствительность клеток пигментного эпителия к наиболее опасному синему свету. Продукты окисления А2Е способны разрушать макромолекулы клеток. Вдобавок, А2Е может ингибировать цитохромоксидазу, что приводит к прерыванию цепи переноса электронов. Это не только снижает эффективность энергетического обмена веществ, но также ведет к увеличению активных форм кислорода.
Дистрофический процесс, лежащий в основе развития ВМД, условно можно разделить на стадии, что позволяет выделить три формы ВМД [9]:
I. Неэкссудативная (атрофическая) форма. Она сопровождается ретинальными дефектами пигментного эпителия и образованием друз. Друзы являются первыми признаками заболевания и локализуются между пигментным эпителием и мембраной Бруха, а так же внутри мембраны Бруха. Они состоят из отложений, включающих в себя конечные продукты метаболизма, такие как амилоиды, липопротеины и другие гидрофобные вещества. Формирование друз может быть последствием неполного разрушения конечных продуктов метаболизма, как фоторецепторов, так и клеток пигментного эпителия. Хотя более детальный анализ белкового состава друз привел к альтернативной теории их формирования. Согласно этой теории, формирование друз начинается с гибели клеток пигментного эпителия, которая происходит вследствие воспалительного процесса. Образующаяся в результате брешь в эпителиальном барьере активно застраивается соседними клетками пигментного эпителия, которые секретируют новый внеклеточный матрикс. Эту теорию подтверждает обнаружение активных дендритных клеток и активных компонентов системы комплемента в друзах. Гидрофобные вещества и липопротеины могут быть остатками органических веществ, образовавшихся после неполного разрушения клеток.
II. Экссудативная (неоваскулярная) форма. Она подразделяется на 4 стадии, по мере развития которых наблюдаются рост кровеносных сосудов в сосудистой оболочке глаза, экссудативный отёк и кровоизлияния в сетчатку. В развитии неоваскулярной формы ВМД большое значение имеет фактор роста эндотелия сосудов (vascular endothelial growth factor - VEGF), который секретируется клетками ретинального пигментного эпителия. VEGF – основной ангиогенный фактор, в норме синтезируемый в малых количествах. При гипоксии синтез фактора VEGF в клетках пигментного эпителия значительно увеличивается. Он секретируется с базальной части клеток в межклеточный матрикс, а затем проникает через мембрану Бруха к сосудам хориоидеи. Связываясь с клетками эндотелия хориокапилляров, VEGF запускает сигнальный каскад, который приводит к синтезу белков, контролирующих клеточную пролиферацию. Это приводит к прорастанию аномальных сосудов вглубь сетчатки. Патологический ангиогенез, в конечном итоге, ведет к формированию отека, кровоизлиянию в сетчатку, ее отслойке. Такие осложнения неоваскулярной ВМД являются наиболее опасными и могут привести к потере зрения.
III. Рубцовая форма, заканчивающаяся формированием дисковидного фиброзного рубца.
Обследование пациентов, страдающих возрастной макулярной дегенерацией, включает определение остроты зрения и биомикроскопию, которую проводят для выявления других причин появления симптоматики (например, для дифференцировки с возрастной катарактой). Для диагностики заболевания применяются два основных метода – флюоресцентная ангиография и осмотр глазного дна, позволяющая не только дифференцировать заболевание, но и выявить различные формы ВМД [10]. Часто пациентам предлагается пройти минутный тест – сетку Амслера. Искажение вертикальных или горизонтальных линий – метаморфопсии, а также расплывчивость контуров центральной точки могут свидетельствовать о развитии возрастной макулярной дегенерации.
На стадии появления мягких друз, которые выявляются офтальмоскопически и являются самым первым симптомом ВМД, пациенту рекомендуется проводить ежедневный самоконтроль при помощи сетки Амслера и обязательное посещение офтальмолога в случае появления новых симптомов заболевания.
Несмотря на разработку множества подходов к лечению и активный поиск мишеней лекарственной терапии, эффективных методов лечения ВМД не найдено. Все существующие методы лечения носят лишь поддерживающий характер, то есть, направлены на предотвращение дальнейшей потери зрения, а не на его улучшение. Цели лечения сводятся, прежде всего, к предупреждению осложнений (при атрофической форме – появлению субретинальной неоваскуляризации, при экссудативной – возникновению кровоизлияний в сетчатку различной локализации).
На сегодняшний день к основным способам лечения ВМД относят интравитреальную анти-VEGF терапию, фотодинамическую терапию субфовеальных очагов и фотокоагуляцию аргоновым лазером хориоидальной неоваскуляризации [11]. Причём до недавних пор термическая лазерная фотокоагуляция считалась единственной общепринятой эффективной методикой, широко использовавшейся для лечения ВМД. При данном виде вмешательства луч аргонового или другого лазера видимого спектра с помощью щелевой лампы направляют к области хориоидальной неоваскуляризации, определенной с помощью ангиографии. Энергия лазера абсорбируется, главным образом, меланиновым пигментом ретинального пигментного эпителия, а оставшаяся тепловая энергия коагулирует и разрушает рядом лежащие сосуды неоваскулярной мембраны. Целью данной терапии является ограничение скотомы, так чтобы конечный ее размер стал меньше, чем размер скотомы без лечения [12]. Альтернативой лазерокоагуляции стала фотодинамическая терапия (ФТД). ФДТ обусловлена способностью фотосенсибилизатора избирательно накапливаться в делящихся клетках и при воздействии света с длиной волны, соответствующей пику поглощения фотосенсибилизатора, генерировать синглетный кислород и другие активные радикалы, оказывающие цитотоксический эффект. Кроме того, ФДТ вызывает фотодинамическую окклюзию новообразованных сосудов с сохранением окружающих структур (сетчатки, пигментного эпителия, хориокапилляров). При лечении используют фотосенсибилизатор для внутривенного введения вертепорфирин (визудин), разрешённый к применению в России. Наиболее перспективным из трех перечисленных методов лечения является интравитреальное введение препаратов, ингибирующих ангиогенез, а именно связывающих фактор роста эндотелия сосудов. В клинике на сегодняшний день используются несколько таких препаратов: пегаптаниб (олигонуклеотид), связывающий одну изоформу VEGF165, ранибизумаб (фрагмент моноклонального антитела к VEGF) и бевацизумаб (полное антитело к VEGF), применяемый в рамках клинических исследований [13].
Такие способы лечения как радиотерапия и транспуппилярная термотерапия на сегодняшний день существенной роли в лечении ВМД не играют. Хирургические методики, включающие удаление субретинальных неоваскулярных мембран, в настоящее время находятся на стадии эксперимента и являются доступными лишь в некоторых клиниках.
Известно, что в развитии ВМД большое значение имеют окислительный стресс и повреждающее действие синего света. В связи с этим в последнее время широкое применение получило употребление препаратов, содержащих каротиноиды - лютеин и зеаксантин. Они накапливаются в макуле и образуют макулярный пигмент. Макулярный радикалы. Он желтого цвета и поэтому абсорбирует синий свет. Поскольку известно, что синий свет и свободные радикалы способствуют развитию ВМД, вполне очевидно, что этот пигмент может сыграть определенную роль в защите от этой патологии [14]. В настоящее время в США препаратом номер один, применяемым для профилактики и лечения ВМД, является «Окувайт Лютеин». Формула Окувайт Лютеина включает в себя как водо-, так и жирорастворимые компоненты: каротиноиды (лютеин и зеаксантин), витамины-антиоксиданты (С и Е), микроэлементы (цинк и селен). Практика показывает, что наилучшее всасывание ингредиентов происходит в небольших дозах, учтенных при производстве препарата. Окувайт Лютеин прекрасно зарекомендовал себя в многочисленных исследованиях, а также в клинической практике многих офтальмологов в разных странах мира.
Для лечения неэкссудативной формы возрастной макулярной дегенерации применяются препараты, содержащие чернику, ангиопротекторные препараты, статины, снижающие уровень холестерина, и антиоксиданты [15-17]. Все эти препараты находят свое применение и в профилактике развития ВМД.
Как уже упоминалось, в настоящее время ведется активный поиск новых подходов к лечению возрастной макулярной дегенерации. Как показали многочисленные исследования, молекулы, составляющие основу патогенеза болезни, принимают участие в зрительном цикле, межклеточных взаимодействиях, окислительных реакциях, являются основой внеклеточного матрикса. Эти молекулы могут стать потенциальными мишенями терапии ВМД. Так, изучение зрительного цикла на клеточном и молекулярном уровне открывает современной медицине новые направления поиска препаратов, препятствующих прогрессированию дегенеративных процессов в структурах глаза и, в частности, в сетчатке [18]. Учёными выявлено, что мутация гена практически любого участника зрительного каскада приводит к дегенеративным изменениям сетчатки (на рисунке 2 обозначены мутации локусов генов, кодирующих белки, принимающие участие в зрительном цикле [1]). Следовательно, успех борьбы с развитием возрастной макулярной дегенерации во многом зависит от развития других ветвей медицины, в частности, открытия в области генетики могут внести значительный вклад в разработку методов лечения, и, что не менее важно, путей профилактики ВМД.
В настоящее время осуществляется активный поиск препаратов (антагонистов, блокаторов, активаторов белков, участвующих в зрительном цикле), препятствующих образованию, либо тормозящих накопление токсичного А2Е, а, следовательно, снижающих риск наступления слепоты (рис. 3) [19, 20]. В частности, активно исследуются антагонисты белка Rpe65 – важного участника зрительного цикла. Шаперон Rpe65 занимает центральное место в сложном ансамбле белков – мультиферментном комплексе, функционирующем в клетках пигментного эпителия. Функция Rpe65 состоит в извлечении нерастворимых транс-ретиниловых эфиров из мембраны и представлении их изомерогидролазе, которая, в свою очередь, используя энергию гидролиза транс-ретиниловых эфиров, превращает их в 11-цис-ретинол. Rpe65 в настоящее время рассматривается как мишень лекарственной терапии при макулярной дегенерации. Существует целая индустрия по поиску антагонистов Rpe65. В качестве таких препаратов предлагаются различные ретиноиды: например, изотретиноин (13-цис-ретиноидная кислота) и его модификации. Изотретиноин частично блокирует действие Rpe65, что снижает эффективность зрительного цикла и, как следствие, уменьшает образование токсичного А2Е [21, 22].
Иной мишенью в лечении ВМД, позволяющей снизить прогрессию заболевания, являются белки фибулины. Доказано, что эти белки являются одним из важнейших компонентов, модулирующим функцию мембраны Бруха, которая претерпевает патологические изменения при ВМД. На основе этих белков, являющихся шаперонами межклеточного матрикса, возможно создание лекарств, где фибулины будут выступать в качестве стабилизаторов межклеточного матрикса, а в частности мембраны Бруха. Недавнее открытие фибулинов позволило исследователям молекулярных основ зрения предположить, что их дефект может быть одной из причин ВМД (рис. 4). Так, например, мутации фибулина 5, находящегося в мембране Бруха и участвующего в формировании и организации эластических волокон, ведут к нарушению ее функции и, как следствие, нарушению фагоцитарной и лизисной способности ретинального пигментного эпителия. Этот процесс заканчивается накоплением липофусцина, ведущего к образованию друз [23]. Впоследствии увеличивающиеся в размерах друзы приводят к образованию дефектов в мембране Бруха и атрофии пигментного эпителия. Через дефекты в мембране Бруха экссудат, образующийся в результате повышенной проницаемости сосудов хориокапиллярного слоя, проникает под пигментный эпителий, приводя к экссудативной отслойке последнего, вызывая отек и гипоксию ретинальной ткани. Так ряд этих факторов способствует развитию макулярной дегенерации сетчатки.
Другим направлением поиска эффективного лечения ВМД является изучение свойств многофункционального белка эритропоэтина, рецепторы к которому имеются на внутреннем сегменте фоторецептора. Было замечено, что нейроны сетчатки, перенесшие гипоксию, более устойчивы к избыточному действию света вследствие торможения апоптоза. Гипоксия вызывает стабилизацию гипоксия-индуцированного фактора-1 (hypoxia-induced factor HIF-1), который является транскрипционным фактором для различных генов, кодирующих белки, повышающие адаптацию тканей к гипоксии. Такими белками являются VEGF и эритропоэтин. Именно последний белок, активируя рецептор эритропоэтина фоторецепторной клетки, ингибирует апоптоз нейрона - процесс, который, как известно, является одной из причин потери зрения при ВМД. Эритропоэтин, помимо нейропротекторного действия (предотвращения апоптоза) обладает и другими эффектами: стимуляцией эритропоэза и ангиогенеза. Поэтому выделение части белковой молекулы эритропоэтина, определяющей только нейропротективное действие, или синтез полипептида, обладающего подобными эритропоэтину свойствами в отношении апоптоза фоторецепторов, позволит предотвратить многочисленные побочные эффекты. [24].
Перспективным направлением в лечении ВМД является также поиск агонистов рецепторов активации пероксисом, или PPAR (peroxisome proliferator-activated receptors). Они обладают противовоспалительным и нейропротекторным действием, принимают участие во многих метаболических цепочках, в том числе и в тех, которые составляют основу патогенеза ВМД: обмене липидов, антиоксидантной защите, регуляции иммунного ответа, реализации действия VEGF и экспрессии генов матриксных металлопротеиназ (рис.5). Известны 3 изоформы PPAR: ?, ? и ?. Изоформы ? и ? найдены в клетках сетчатки, моноцитах и макрофагах, принимающих участие в развитии ВМД. Агонистами PPAR? и PPAR? являются фенофибрат и тиозолидиндион (троглитазон) соответственно, также рецепторы активации пероксисом могут взаимодействовать с другими веществами липидной природы [25, 26]. Очевидно, что необходимы дальнейшие исследования роли важных метаболических рецепторов PPAR в сетчатке, их влияния на экспрессию генов при ВМД. Расширение знаний о ядерных рецепторах PPAR позволит найти пути воздействия на функцию разных форм данных рецепторов и сделать лечение более избирательным.
Поскольку доказано, что в развитии ВМД важная роль принадлежит генетическим факторам, в будущем большой вклад в развитие методов лечения ВМД внесут исследования генома каждого конкретного пациента, которые позволят относить пациентов к определенным группам риска развития патологии. Генетические тесты позволят врачу осуществлять раннюю эффективную профилактику и подбирать индивидуальные схемы лечения [1].
В данной работе использованы научные проекты авторов – выпускников Биохимической Школы Эссеистов кафедры биологической химии ММА им. И.М. Сеченова:
- Болбас Зои Васильевны «Влияние белков межклеточного матрикса на развитие возрастных заболеваний глаза», 2006 год
- Василевской Натальи Анатольевны «Взаимодействие молекул и клеток в зрительном цикле: шаперон RPE65 как мишень лекарственной терапии при макулярной дегенерации», 2006.
- Чикун Екатерины Анатольевны «Некоторые молекулярные аспекты неоваскуляризации при возрастной макулярной дегенерации», 2008.
Иллюстрации:
Рис. 1. Интегральная модель патогенеза ВМД
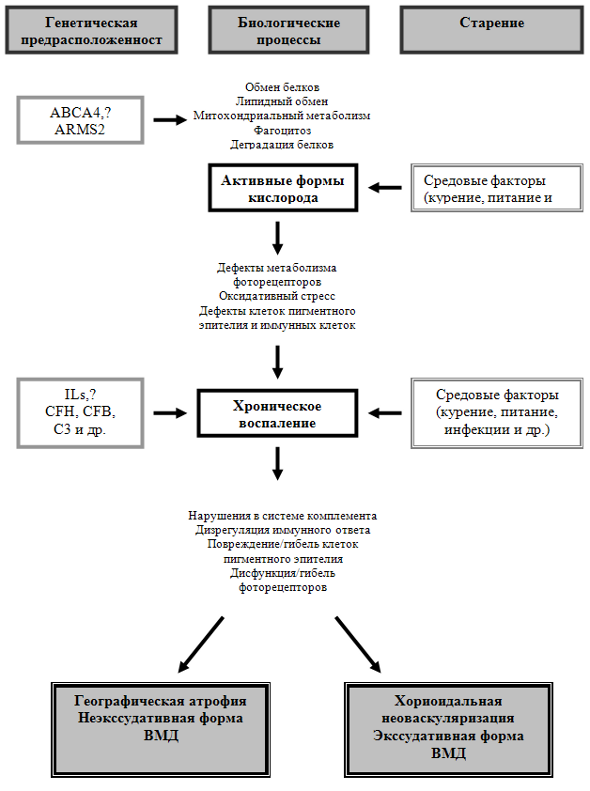
Старение – первичный фактор, приводящий к повреждениям фоторецепторов и клеток ретинального пигментного эпителия; эти повреждения связаны с различными генетическими изменениями. Комплемент и иммунный ответ также играют важную роль в возникновении и прогрессировании ВМД [1].
Рис. 2. Схематическое изображение хромосом человека
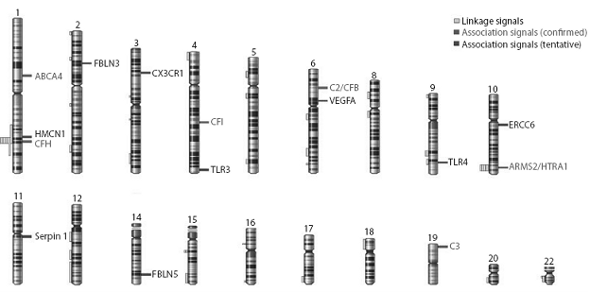
Показаны локусы, мутации которых приводят к развитию ВМД.
Рис. 3. Схематическое изображение зрительного цикла
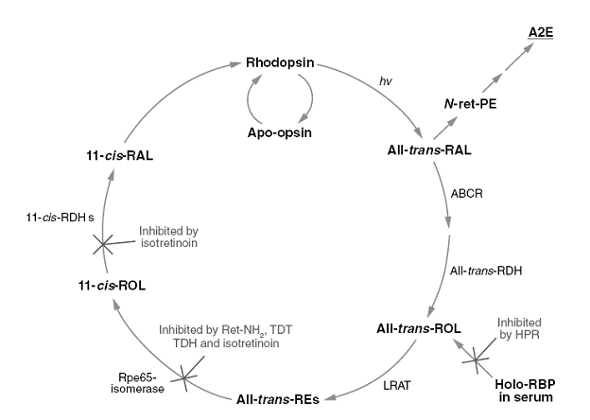
Иллюстрирует точки приложения ингибиторов образования, N-ретинилидин-N-ретинил этаноламина (А2Е).
Полностью-транс-ретиналь, высвобождаемый при фотоизимеризации родопсина, соединяется с фосфатидилэтаноламином (PE) в мембранах дисков, образуя при этом N-ретилидин-PE (N-ret-PE). Затем соединение N-ret-PE с другим полностью-транс-ретиналем, следующее за электроциклизацией, гидролизом фосфатных эфиров и окислением, приводит к образованию А2Е. Фармакологическое вмешательство, которое уменьшает свет-индуцированное образование полностью-транс-ретиналя, приводит к значительному снижению вероятности этого второго присоединения и замедляет образование А2Е. N-(4-гидроксифенил)-ретинамид (HPR) приводит к снижению уровня ретинолсвязывающего белка (RBP) в плазме. Rpe65-опосредованная изомеризация может быть блокирована с помощью ретиниламина (Ret-NH2), фарнесилсодержащих аналогов, TDH и TDT, изотретиноина. Изотретиноин также ингибирует 11-цис-ретинол дегидрогеназу (11-cis-RDH)
Рис. 4. Модулирующие действие фибулинов
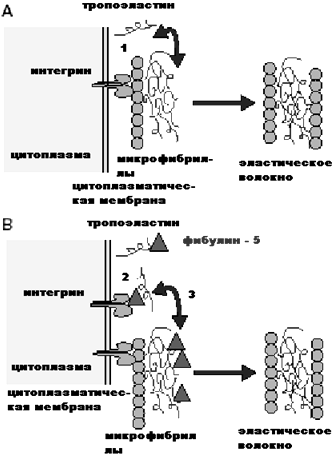
Взаимодействие фибулина 5 (изображён в форме треугольника) с динамическими интегриновыми рецепторами, а также с тропоэластином; влияние фибулина 5 на формирование эластических волокон и собирание микрофибрилл в определённые структуры, а именно: фибулины участвуют в формировании клеточного ответа в виде изменения роста, морфологии и строения клеточных структур. При этом фибулины задействованы не только в восприятии и передаче сигналов от интегринов к межклеточному пространству мембраны Бруха, но и в обратной передаче этих сигналов к внутриклеточным компонентам.
Рис. 5. Значение PPAR рецепторов в предупреждении развития ВМД
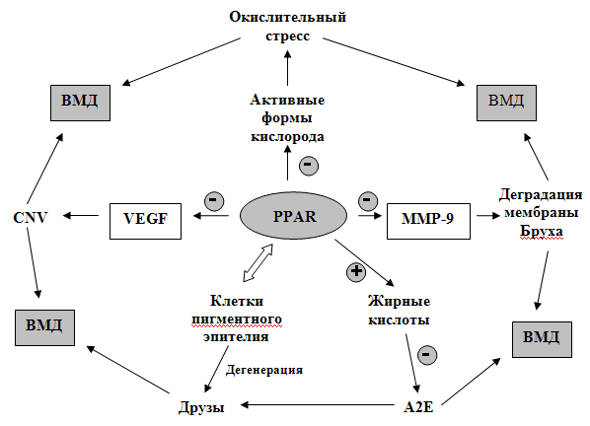
Лигандами PPAR рецепторов являются жирные кислоты. У здорового человека PPAR связывают их, но с возрастом активность рецепторов снижается, происходит накопление жира, липофусцина (главный компонент бисретиноид А2Е), что приводит к образованию друз и развитию ВМД. Активность PPAR уменьшает экспрессию матриксной металлопротеиназы (ММР-9), которая приводит к деградации мембраны Бруха, образованию сосудов с хрупкими стенками. ММР – протеаза, синтезируемая клетками-макрофагами, разрушает внеклеточный матрикс. Также PPAR рецепторы ингибируют (путём активации транскрипции антиоксидантных генов, таких как глутамат-цистеин лигазы) образование свободных форм кислорода (пероксида водорода, свободного кислорода, токсичных радикалов кислорода), которые приводят к окислительному стрессу и развитию ВМД. PPAR рецепторы ингибируют пролиферацию эндотелиальных клеток, вызванную действием фактора роста эндотелия сосудов (VEGF). Таким образом, тормозится процесс неоваскуляризации (CNV) и развитие экссудативной формы ВМД.
Литература
1. Anand Swaroop, Emily Y. Chew, Catherine Bowes Rickman, and Goncalo R. Abecasis. Unraveling a Multifactorial Late-Onset Disease: From Genetic Susceptibility to Disease Mechanisms for Age-Related Macular Degeneration. Annu Rev Genomic Hum Genet 2009; 10:19-43.
2. Klaver C. C., Wolts R. S., Vingerling J. R. et al. Arch Ophthalmol 1998; 116:653–8.
3. Klein R., Klein B. E. K., Lee K. E., et al. Changes in visual acuity in population over a 10– year period. The Beaver Dam Study. Ophthalmol 2001; 108: 1757–66.
4. Williams R. A., Brady B. L., Thomas R. J. The psychosocial impact of macular degeneration. Arch Ophthalmol 1998; 116 (4):514–20.
5. Hyman L., Schachat A.P., He Q., Leske M.CArch Ophthalmol 2000; 188(4):351–8.
6. Edwin M. Stone, M.D., Ph.D., Terry A. Braun, Ph.D., Stephen R. Russell, M.D.,
Markus H. Kuehn, Ph.D., Andrew J. Lotery, M.D., Paula A. Moore. Missense Variations in the Fibulin 5 Gene and Age-Related Macular Degeneration. NEJM 2004; 351 ( 4):346-53.
7. Stuart L. Fine, M. D., Jeffrey W. Berger, M. D., Ph. D., Maureen G. Maguire, Ph. D., and Allen C. Ho, M. D. Age-Related Macular Degeneration. 2000; 342 (7); 483-91.
8. Edwin M. Stone. Macular Degeneration. Annu Rev Med – 2007; 58:477–90.
9. Л.А. Кацнельсон Клинический атлас патологии глазного дна. 2008 г, стр. 59
10. С.Э.Аветисов, Е.А.Егоров, Офтальмология: национальное руководство, 2008 г, стр.623-637.
11. Jeganathan VS, Verma N. Safety and efficacy of intravitreal anti-VEGF injections for age-related macular degeneration. Curr Opin Ophthalmol. 2009; 20:223-5.
12. Bylsma Guy W., Guymer Robyn H. Австралия Clin Exp Optom 2005; 88: 5: 322–334
13. Brown DM, Michels M, Kaiser PK, Heier JS, Sy JP, Ianchulev T. Ranibizumab versus verteporfin photodynamic therapy for age-related macular degeneration: Two-year results of the ANCHOR study. Ophthalmology. 2009; 116:57-65.
14. Даль Н. Ю. Макулярные каротиноиды. Могут ли они защитить нас от возрастной макулярной дегенерации? Офтальм ведомости 2008; 1 (3): 51–3.
15. Л.В. Журавлёва, С.А. Коскин, Е.Ю. Бузина, А.В.Ян, А.В. Иванова, С.М. Аветисян, Мониторинг больных возрастной макулодистрофией при комплексном их лечении препаратами растительного происхождения. Российский медицинский журнал, Клиническая офтальмология 2008; 9 (1):24-6.
16. С.Э.Аветисов, Т.Н. Киселёва, Ю.М.Лагутина, Е.А.Кравчук, Влияние вазоактивных препаратов на зрительные функции и глазной кровоток у больных с ранними проявлениями возрастной макулярной дегенерацией. Вестник офтальмологии 2007; 3:
17. Т.Н. Малишевская, И.Г. Долгова, Э.А.Ортенберг, Изучение влияния препаратов Стрикс и Стрикс форте на зрительные функции больных с возрастной патологией сетчатки и зрительного нерва. Российский медицинский журнал, Клиническая офтальмология 2008; 9 (1): 20-4.
18. Janis Lem. Diseases of G-Protein-Coupled Signal Transduction Pathways: The Mammalian Visual System as a Model. 1998; Seminars in Neuroscience 9, Article No. SN980126; 232-8.
19. Olaf Strauss. The Petinal Pigmentum Epithelium in Visual Function. 2005, Physiol Rev 85:845-881; pp. 845-865.
20. Gabriel H. Travis, Marcin Golczak, Alexander R. Moise, and Krzysztof Palczewski. Diseases Caused by Defects in the Visual Cycle: Retinoids as Potential Therapeutic Agents. Annu Rev Pharmacol Toxicol 2007; 47:469-512.
21. Nathan L. Mata, Walid N. Moghrabi, Jung S. Lee et. al. Rpe65 Is a Retinyl Ester Binding Protein That Presents Insoluble Substrate to the Isomerase in Retinal Pigment Epithelial Cells. 2004; 279 (1) Issue of January 2: 635-42.
22. Janet R. Sparrow. Therapy for macular degeneration: Insights from acne. 2003; 100: 8: 4353-4.
23. Kim S. Midwood and Jean E. Schwarzbauer Elastic Fibers: Building Bridges Between Cells and Their Matrix. Current Biology 2002; 12: R279–R281.
24. Erythropoetin – An Endogenous Retinal Survival Factor. N Engl J Med 2002; 347 (24): 1968-70.
25. Marisol del V Cano and Peter L.Gehlbach. PPAR Ligands as Potential Therapeutic Agents for Wet Age-Related Macular Degeneration. Hindawi Publishing Corporation, PPAR Reseach, Vol. 2008, article ID 821592.
26. AlexandraA.Herzlich, JingshengTuo andChi-ChaoChan. Peroxisome Prolife rator-Activated Receptor and Age-RelatedMacularDegeneration. Hindawi Publishing Corporation, PPAR Reseach, Vol. 2008, article ID 389507.